
分析 (1)除去Fe2+时,应避免Cu2+生成沉淀;加入氧化剂时,不能引入新的杂质;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质;
(3)铜离子水解生成盐酸易挥发,不能得到氯化铜.
解答 解:(1)由题给信息可知,除去Fe2+时,应避免Cu2+生成沉淀,如直接调整溶液pH=9.6,则生成氢氧化亚铁的同时,氢氧化铜、氢氧化铁也同时生成;加入氧化剂时,不能引入新的杂质,如用NaClO,则可引入NaCl杂质,浓硝酸、高锰酸钾的还原产物均引入新杂质,应加入过氧化氢,
故答案为:Cu2+也被完全沉淀了;②;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,氨水、NaOH均引入新杂质,则可用CuO 或Cu(OH)2或CuCO3;
故答案为:①③;
(3)加热促进铜离子水解,铜离子水解生成盐酸易挥发,不能得到氯化铜,故答案为:不能.
点评 本题考查较为综合,涉及物质的分离、提纯和制备,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及题给信息,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
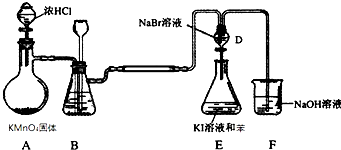
| A. | 装置E下层呈现紫红色 | |
| B. | 装置B中可盛放水吸收氯气中的HCl气体 | |
| C. | F2不能与NaCl溶液反应置换出氯气 | |
| D. | 装置E中有机试剂层呈现紫红色,能说明非金属性Br>I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素水解的最终产物均为葡萄糖 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| C. | 葡萄糖既可以与银氨溶液反应,又可以与新制氢氧化铜悬浊液反应 | |
| D. | 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钢闸门与直流电源的正极相连,可降低钢闸门腐蚀速率 | |
| B. | 镀锌铁制品镀层受损后,铁制品仍不易生锈 | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 纯银在空气中久置变黑发生的是电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol Fe与足量稀HNO3反应,转移电子的数目为2NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 标准状况下,22.4L二氯甲烷的分子数约为NA | |
| D. | 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若5.6LN2中含有n个氮分子,则阿伏加德罗常数一定为4n | |
| B. | 4.6gNa与100 mL含0.1mol HCl的盐酸溶液反应,转移电子数目为0.2NA | |
| C. | 14g乙烯和丙烯的混合气体中所含分子总数为0.5NA | |
| D. | 标准状况下,22.4LCCl4含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n=m+1 | B. | n=m+10 | C. | n=m+11 | D. | n=m+25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com