
| A. | HCl气体溶于水 | B. | 碘单质升华 | ||
| C. | 氯化镁受热熔化 | D. | 二氧化硅受热熔化 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干法中生成的高铁酸钠既是氧化产物又是还原产物 | |
| B. | 湿法中每生成1mol Na2FeO4 转移3mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4 转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO溶于稀盐酸中:O2-+2H+═H2O | |
| B. | 碳酸钙中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 实验室用MnO2反应制Cl2:MnO2+2H++2Cl-═Cl2↑+Mn2++H2O | |
| D. | 向氢氧化钠溶液中通入过量二氧化碳:OH-+CO2=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 热化学方程式 | △H |
| 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(1) | -2600 kJ•mol-1 |
| 2C6H6(g)+15O2(g)═12CO2(g)+6H2O(1) | -6590 kJ•mol-1 |
| 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g) | -a kJ•mol-1 |
| 2C6H6(1)+15O2(g)═12CO2(g)+6H2O(1) | -b kJ•mol-1 |
| A. | a>2600 | |
| B. | b>6590 | |
| C. | 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C2H2(g)放热更多 | |
| D. | C2H2(g)三聚生成C6H6(g)的过程属于吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
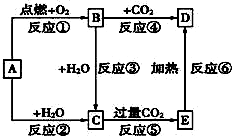 如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去).
如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去). 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com