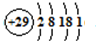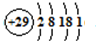分析:(1)C
60分子含有30个共价键,发生加成反应时一个C
60分子中含有的碳碳双键个数和氟气分子个数相同,1molC
60分子中30mol碳碳双键,所以需要30mol氟气,根据原子守恒写出加成产物的化学式;C
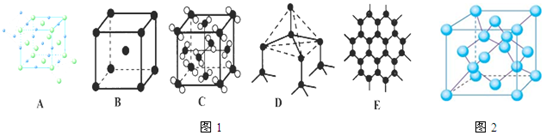
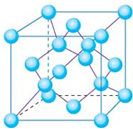
60晶体为面心立方排布,所以每个C
60晶胞有4个C
60分子 (面心3个,顶点1个),所以一个C
60晶胞=
×12;
(2)水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,而受热融化时氢键被破,干冰分子之间只存在范德华力,形成的分子晶体是密堆积;
(3)a、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构;
bc、sp
2杂化中,s轨道的成分比sp
3杂化更多,而且石墨的碳原子还有大π键所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量;
d、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,石墨中的碳原子用sp
2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构;
e、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,晶体中只含有共价键;石墨中的碳原子用sp
2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp
2杂化轨道构成的平面,形成了大π键.因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质,石墨为层状结构,层与层之间通过范德华力连接;
f、石墨为层状结构,层与层之间通过范德华力连接;
(4)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,根据金刚石的结构判断,在BN晶体中,每个B原子和4个N原子形成共价键,所以B原子周围最近的N原子所构成的立体图形为正四面体;B原子的配位数是4,B原子与N原子之间共价键的数目是12,一个晶胞中N原子数目为 4;
(5)铜是29号元素,根据核外电子排布规律写出核外电子排布式再画出原子结构示意图.金属铜采用面心立方最密堆积,晶胞内Cu原子数目为8×
+6×
=4,令铜原子的比较为rcm,则晶胞的棱长为
×4rcm=2
rcm,所以
(2r)3ρ=4,据此计算铜原子半径.
解答:解:(1)C
60分子含有30个共价键,发生加成反应时一个C
60分子中含有的碳碳双键个数和氟气分子个数相同,1molC
60分子中30mol碳碳双键,所以需要30mol氟气,所以其加成产物的化学式为:C
60F
60;C
60晶体为面心立方排布,所以每个C
60晶胞有4个C
60分子 (面心3个,顶点1个),所以一个C
60晶胞=
×12=
g,
故答案为:C
60F
60;
g;
(2)a、水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,密度比水小,干冰分子之间只存在范德华力,形成的分子晶体是密堆积,密度比水大,故a正确;
b、冰融化时氢键被破,干冰分子之间只存在范德华力,融化时破坏范德华力,氢键比范德华力强,故晶体的熔点冰>干冰,故b错误;
c、水分子间存在氢键,且氢键有方向性,导致水分子形成冰时存在较大的空隙,干冰分子之间只存在范德华力,形成的分子晶体是密堆积,晶体中的空间利用率:干冰>冰,故c正确;
d、干冰分子之间存在范德华力,水分子间存在氢键,晶体中分子间相互作用力类型不相同,故d错误.
故选:ac;
(3)a、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,碳原子的杂化类型为sp
3杂化;石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp
2杂化,故a正确;
b、sp
2杂化中,s轨道的成分比sp
3杂化更多,而且石墨的碳原子还有大π键所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的键长短,故b错误;
c、石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量,所以晶体的熔点金刚石<石墨,故c错误;
d、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,键角为109°28′,石墨中的碳原子用sp
2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,键角为120°,故d错误;
e、金刚石中碳原子与四个碳原子形成4个共价单键,构成正四面体,石墨中的碳原子用sp
2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp
2杂化轨道构成的平面,形成了大π键.因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质,石墨为层状结构,层与层之间通过范德华力连接,说明晶体中含有共价键、金属键、范德华力,故e正确;
f、金刚石是原子晶体,石墨为层状结构,层与层之间通过范德华力连接,石墨为混合型晶体,不属于原子晶体,故f错误;
故选:ae;
(4)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,在BN晶体中,每个B原子和4个N原子形成共价键,所以B原子周围最近的N原子所构成的立体图形为正四面体;B原子的配位数是4,B原子与N原子之间共价键的数目是12,所以B原子与N原子之间共价键的数目与配位键的数目比为 3:1,一个晶胞中N原子数目为 4,
故答案为:正四面体;3:1;4;
(5)铜是29号元素,核外电子排布式为1s
22s
22p
63s
23p
63d
104s
1,原子结构示意图为
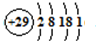
;
金属铜采用面心立方最密堆积,晶胞内Cu原子数目为8×
+6×
=4,令铜原子的半径为rcm,则晶胞的棱长为
为
×4rcm=2
rcm,所以
(2r)3ρ=4,r=
×cm,
故答案为:
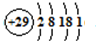
;12;
×.

 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.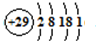
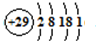
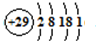 ;
;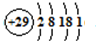 ;12;
;12;