
【题目】由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2—中,两个中心离子铂的化合价是( )
A.都是+8 B.都是+6 C.都是+4 D.都是+2
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是
A.氧化还原反应的本质是元素化合价发生变化
B.物质所含元素化合价降低的反应是氧化反应
C.置换反应一定属于氧化还原反应
D.化合反应和分解反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
(1)Ⅰ.将NaOH溶液与NH4Cl溶液混合生成NH3·H2O ,从而验证NaOH的碱性大于NH3·H2O继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: 。
(2)Ⅱ.利用下图装置可以验证非金属性的变化规律。干燥管D的作用是。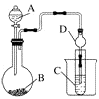
实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫:烧瓶中发生反应的离子方程式为。
装置C中的实验现象为有淡黄色沉淀生成,离子方程式为。
(3)若要用此装置证明酸性:H2CO3>H2SiO3进而证明非金属性:C>Si,则A中加观察到C中溶液的现象为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某反应达到平衡,其平衡常数为K= ![]() 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
A.该反应的化学方程式为:NO2+CO═CO2+NO
B.该反应的焓变为负值
C.升高温度,正反应速率减小
D.恒温时,增大压强,颜色加深,因平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
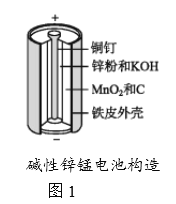
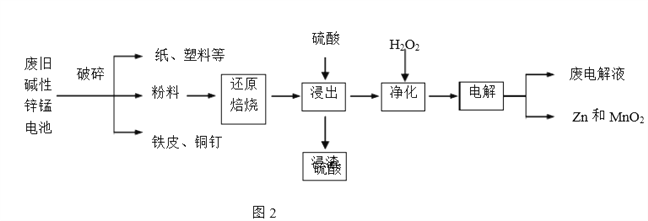
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示。放电时总反应为Zn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
回答下列问题:
(1)碱性锌锰电池中,锌粉、MnO2、KOH的作用分别是(每空只选1个)_______、_______ 、______。
a.正极反应物b. 正极材料 c.负极反应物
d. 负极材料 e. 电子导体 f. 离子导体
(2)“还原焙烧”过程中,无需外加还原剂即可在焙烧过程中将MnOOH、MnO2还原为MnO,起还原作用的物质是___________。
(3)“净化”是在浸出液中先加入H2O2,再加入碱调节溶液pH到4.5左右,再过滤出沉淀。请完整说明这样操作的目的是______________。
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀的pH | 5.5 | 1.9 | 8.0 |
沉淀完全的pH | 8.0 | 3.2 | 10.0 |
(4) “电解”时,阳极的电极反应式为___。本工艺中应循环利用的物质是____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为_____。
(6)某碱性锌锰电池维持电流0.5 A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有____%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molSO2和2molO2充入2L的密闭容器中在一定条件一发生反应,经2s后测定SO2的浓度为0.6 molL-1 , 下列说法中正确的是( )
①用O2表示的反应的平均速率为0.6mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为15%
④2s时O2的浓度为0.7mol·L-1
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是

A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是

A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com