
在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平衡反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30 mol/L
D.反应到6 min时,H2O2分解了50%
科目:高中化学 来源: 题型:
在2L的密闭容器中,充入1mol N2和 3mol H2,在一定条件下反应,2分钟后达到平衡状态,相同温度下,测得混合气体平衡时的压强比反应前混合气体的压强减小1/10,请问:
(1)平衡时混合气体中三种气体物质的量之比为n(N2):n(H2):n(NH3)= 。
(2)N2的转化率为 。
(3)2分钟内,NH3的平均反应速率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在乙酸、乙醇和浓硫酸混合物中,加入H218O,过一段时间后,18O存在于( )
A.只存在于乙酸分子中 B.存在于乙酸和乙酸乙酯中分子中
C.只存在于乙醇分子中 D.存在于水和乙酸分子中
查看答案和解析>>
科目:高中化学 来源: 题型:
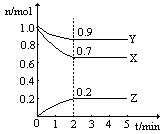
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)从开始至2min,Z的平均反应速率为
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小 D.35Cl2与37Cl2得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
B.l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA
C.1 mol Na2O2固体中含离子总数为4NA
D.常温下,1 mol Fe与过量浓HNO3反应,转移电子的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在放电过程中的总反应方程式是:NiOOH + MH === Ni(OH)2 + M,下列说法错误的是
A.放电过程中负极的电极反应式:MH + OH--e-=== H2O + M
B.放电过程中OH-从正极向负极迁移
C.放电时若有1 mol M生成,则转移的电子数目为NA (NA为阿伏伽德罗常数的值)
D.NiMH电池中不能用KOH溶液作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在浓盐酸中H3AsO3与SnCl2的离子方程式为:3SnCl2+12Cl-+6 H++2H3AsO3=== 2As +3SnCl62-+6M,关于该反应的说法中正确的组合是
①氧化剂是H3AsO3 ②还原性:Cl->As ③ 每生成1mol As,反应中转移电 子的物质的量为3 mol ④ M为OH- ⑤ SnCl62-是氧化产物
子的物质的量为3 mol ④ M为OH- ⑤ SnCl62-是氧化产物
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
查看答案和解析>>
科目:高中化学 来源: 题型:
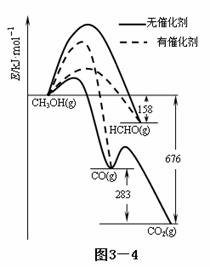
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
(1)人们常用催化剂来选择反应进行的方向。下图3—4所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
①在有催化剂作用下,CH3OH与O2 反应主要生成 (填“CO、CO2、HCHO”);
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
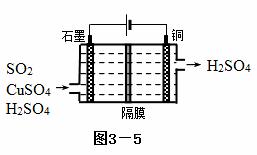
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 g。
②利用上图3—5所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com