
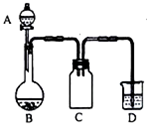
 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:| 实验一 证明H2S是弱酸 | 实验操作 | 取VmL未知浓度的H2S溶液,测其pH值为a,再向溶液中加入适量的无水CuSO4粉末,充分反应后再测其pH值为b,用过滤器将溶液中的不容物滤出,并用蒸馏水洗涤不容物,洗净,晾干并称量质量为m克. |
| 分析及结论 | 由实验中的数据可求得H2S溶液的物质的量浓度为:$\frac{1000m}{96V}$mol•L-1; 通过比较a和b数值的大小(或a>b)说明氢硫酸是弱酸. | |
| 实验原理 | 写出上述实验的化学反应方程式:CuSO4+H2S═CuS↓+H2SO4 | |
| 实验二 证明H2S是二元酸 | 实验操作 | 用已知浓度的NaOH溶液去滴定上述H2S溶液 |
| 分析及结论 | 通过实验若得出2n(H2S)=n(NaOH)(或消耗n(NaOH)为n(H2S)的二倍)即可说明H2S是二元酸 |
分析 A中H2SO4、HNO3混合稀溶液与粗铜屑(含少量的Cu2O)在B中反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O、3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O,D装置吸收生成的NO,防止污染空气,C装置防倒吸,
(1)Cu2O与混酸反应生成铜离子和NO气体;
(2)C装置防倒吸;
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气NO,反应生成氯化钠和硝酸钠;
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,则需要将硝酸根均生成NO,硝酸不能加入过量;
(5)实验一:向H2S中加入无水CuSO4粉末,发生的反应为:CuSO4+H2S═CuS↓+H2SO4,根据S元素质量守恒计算H2S的物质的量,据此计算其物质的量浓度;由H2S生成H2SO4,比较反应前和反应和的pH可得;
实验二:若H2S是二元酸,则消耗的氢氧化钠的物质的量是氢硫酸物质的量的两倍,据此分析.
解答 解:(1)Cu2O与混酸反应生成铜离子和NO气体,离子方程式为:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O;
故答案为:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O;
(2)C装置防止D中溶液到吸入B中(或防倒吸);
故答案为:防止D中溶液到吸入B中(或防倒吸);
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气NO,反应生成氯化钠和硝酸钠,花痴方程式为:3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O;
故答案为:3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O;
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,则需要将硝酸根均生成NO,故应加入的硝酸不过量(或定量加入硝酸);
故答案为:加入的硝酸不过量(或定量加入硝酸);
(5)实验一:向H2S中加入无水CuSO4粉末,发生的反应为:CuSO4+H2S═CuS↓+H2SO4,得mgCuS沉淀,根据S元素质量守恒,则n(H2S)=n(CuS)=$\frac{m}{96}mol$,则VmLH2S溶液的浓度为:$\frac{\frac{m}{96}}{V×1{0}^{-3}L}$=$\frac{1000m}{96V}$mol/L;H2S溶液,测其pH值为a,向溶液中CuSO4粉末生成硫酸,充分反应后再测其pH值为b,若a>b,说明酸性H2S<H2SO4,为弱酸;
故答案为:$\frac{1000m}{96V}$;a和b数值的大小 (或a>b);CuSO4+H2S═CuS↓+H2SO4;
实验二:若H2S是二元酸,则用已知浓度的NaOH溶液去滴定H2S溶液,消耗的氢氧化钠的物质的量是氢硫酸物质的量的两倍,即2n(H2S)=n(NaOH);
故答案为:2n(H2S)=n(NaOH)(或消耗n(NaOH)为n(H2S)的二倍).
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、实验方案设计等,侧重对弱电解质电离平衡的理解,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 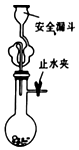 实验室用大理石和盐酸制备二氧化碳 | |
| B. | 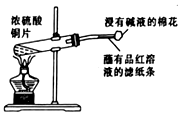 制取SO2、检验SO2的漂白性 | |
| C. | 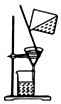 提纯氢氧化铁胶体 | |
| D. | 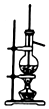 实验室用乙醇和浓硫酸制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
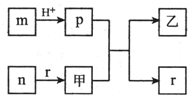 短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )
短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )| A. | 热稳定性:p<r | |
| B. | X与Y组成的化合物一定有漂白性 | |
| C. | 含Y元素的盐溶液可能显酸性、中性或碱性 | |
| D. | Z与W、X、Y可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体总质量保持不变 | B. | 消耗Z的速率与消耗X的速率相等 | ||
| C. | X、Y、Z的浓度不再发生变化 | D. | X、Y、Z的分子数之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+ )=c(OH- )+c(A- ) | |
| B. | 25℃时,pH=4.7浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 氢硫酸的酸性比碳酸弱,则NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-) | |
| D. | ①0.2mol•L-1NH4Cl溶液②0.1mol•L-1(NH4)2Fe(SO4)2溶液③0.2mol•L-1NH4HSO4溶液④0.1mol•L-1(NH4)2CO3溶液中,c(NH4+ )大小:③>②>①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Al3+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z着火时均可用泡沫灭火器进行灭火 | |
| B. | 最高价氧化物对应水化物的碱性:Y>Z | |
| C. | Y、Z、W的简单离子都能促进水的电离 | |
| D. | 原子半径由小到大的顺序:X<W<Z<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
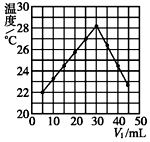 将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )
将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )| A. | 该实验表明所有化学反应化学能只转化为热能 | |
| B. | NaOH溶液的浓度为1.0mol•L-1 | |
| C. | 该实验提供的数据能粗略计算出中和热 | |
| D. | 该实验可分多次把NaOH溶液倒入盛有盐酸的小烧杯中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com