
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ac.(填序号).
ac.(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键能:H-F>H-Cl>H-Br>H-I | |
| B. | 还原性:Cl-<Br-<Fe2+<I- | |
| C. | 反应热:C(s)+O2(g)=CO2(g)△H1CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2△H1>△H2 | |
| D. | 酸性:向次氯酸钠溶液中通入少量的二氧化碳,发生ClO-+CO2+H2O=HCO${\;}_{3}^{-}$+HClO则说明酸性:H2CO3>HClO>HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
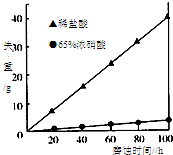 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外,还需要的其它玻璃仪器 |
| 12.5g | 250mL | 烧杯、玻璃棒、胶头滴管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com