
| A. | 可以用灼烧的方法来区别蚕丝和棉花纤维 | |
| B. | 人体内氨基酸分解代谢的最终产物是二氧化碳、水、尿素 | |
| C. | 人体内所有氨基酸都可以相互转化 | |
| D. | 蛋白质遇硝酸都能显黄色 |
分析 A.蛋白质在灼烧时有烧焦羽毛的气味;
B.氨基酸含碳、氢、氧、氮;
C.人体内的氨基酸有的可以在体内转化成为非必需氨基酸,有的不能转化;
D.蛋白质能发生颜色反应.
解答 解:A.蛋白质在灼烧时有烧焦羽毛的气味,棉花燃烧产生白色灰烬,故A正确;
B.氨基酸经过脱氨基作用,含氮部分转化成尿素,不含氮部分氧化分解产生二氧化碳和水,故B正确;
C.人体内的氨基酸有的可以在体内转化成为非必需氨基酸,有的不能转化,只能从食物中获得,成为必需氨基酸,故C错误;
D.蛋白质遇浓硝酸有颜色反应,故D正确.
故选C.
点评 本题考查氨基酸、蛋白质的结构和性质特点,对组成蛋白质的氨基酸的结构通式、氨基酸的分类和分类依据、氨基酸代谢的产物和氨基酸的脱水缩合反应的综合理解,并把握知识点间的内在联系是解题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
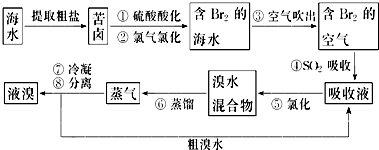
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
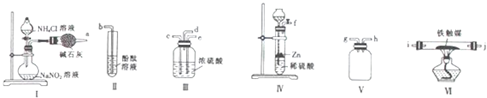
 f,e;d,i,j,g,h,b(填玻璃接口字母)
f,e;d,i,j,g,h,b(填玻璃接口字母)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1molNH4+ 所含质子数为10NA | |
| B. | 常温常压下,48gO2与O3混合气体中所含原子数为3NA | |
| C. | 22.4LSO2所含的分子数为NA | |
| D. | 同温同压下,体积相同的氢气和氧气所含的分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层只有1个电子的原子一定是金属元素的原子 | |
| B. | 最外层只有2个电子的原子一定是金属元素的原子 | |
| C. | 原子核外各电子层电子数相等的原子一定是金属元素的原子 | |
| D. | 最外层电子数最多的原子最容易获得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 增大压强 | C的体积分数 |
| B | 使用催化剂 | C的平衡浓度 |
| C | 充入A | B的转化率 |
| D | 降低温度 | 超过活化能Ea的活化分子百分数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸溶液:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铜与硝酸银溶液:Cu+Ag+=Cu2++Ag | |
| C. | 碳酸钙加入稀盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | 氢氧化钠溶液加入稀硫酸:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用容量瓶配制100ml 2.000mol/L的NaCl | |
| B. | 用分液漏斗分离乙醇和水 | |
| C. | 用烧杯溶解FeCl3试样 | |
| D. | 用电子天平称量NaCl固体5.85g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com