
某化合物6.2g在氧气中完全燃烧,只生成8.8gCO2和5.4gH2O.下列说法正确的是
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个教比为1:2
C.无法确定该化合物是否含有氧元素
D.该化合物中一定含有氧元素
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源:2015-2016学年四川阆中中学校高二上第二次段考化学试卷(解析版) 题型:选择题
把一小块钠投入水中,不会出现的现象是
A.钠浮在水面上 B.钠熔化成银白色的小球,不停地游动
C.溶液由无色变为红色 D.发出“嘶嘶”响声
查看答案和解析>>
科目:高中化学 来源:2015-2016年海南省高一上第三次月考化学试卷(解析版) 题型:选择题
以下氧化物既可以与酸反应,又可以与碱反应的是
A.FeO B.Fe2O3 C.Al2O3 D.Fe3O4
查看答案和解析>>
科目:高中化学 来源:2015-2016年湖南湘潭、岳阳两校高二上第三次联考化学卷(解析版) 题型:选择题
下列图像能正确地表达可逆反应3A(g) + B(g) 2C(g) (△H<0) 的是
2C(g) (△H<0) 的是
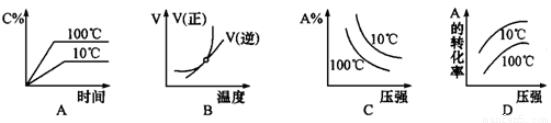
查看答案和解析>>
科目:高中化学 来源:2015-2016年湖南湘潭、岳阳两校高二上第三次联考化学卷(解析版) 题型:选择题
下列物质属于弱电解质的是
A. CH3CH2OH B. SO2 C. NH3·H2O D. HNO3
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:选择题
悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知下列物质燃烧的热化学方程式为: CO:2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol.
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2221.5kJ/mol.
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2878.0kJ/mol.
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2869.6kJ/mol.
下列有关说法正确的是
A.等物质的量正丁烷比异丁烷能量低
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:填空题
I. H2A在水中存在以下平衡:H2A  H+ +HA- ,HA-
H+ +HA- ,HA- H+ +A2-
H+ +A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是______________。
A.c(Na+ )>c(K+ ) B.c(H +)•c(OH )=1×10-14
C.c(Na+ )=c(K+ ) D.c(Na+ )+c(K+ )=c(HA- )+c(A2-)
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72- 。为使废水能达标排放,作如下处理:

(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为: 。
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入_________g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+ 的浓度为_________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III. 已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2015-2016年山东省高一上12月月考化学试卷(解析版) 题型:填空题
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。
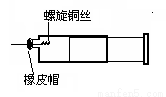
(1)请写出铜与稀硝酸反应的化学方程式__________________。
(2)若证明无色气体是NO的实验操作和现象是________________。
一氧化氮是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水。该反应的化学方程式为4NH3+6NO 5N2+6H2O,每有10mol N2生成,氧化产物与还原产物的比___________,反应中转移的电子的电子数为___________。
5N2+6H2O,每有10mol N2生成,氧化产物与还原产物的比___________,反应中转移的电子的电子数为___________。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体通入水中,发生反应的化学方程式为____________。
(4)分别将等质量的铜片与等体积过量的浓、稀硝酸反应,所得溶液前者呈绿色,后者呈蓝色。某同学认为可能是Cu2+浓度的差异引起的,你认为是否正确? (填“正确”或“不正确”),理由是 。
(5)①写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式:__________________;检验氨 气已收集满的方法是: 。
②进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是_______________、______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西省高二上12月月考化学试卷(教师版) 题型:选择题
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是
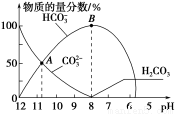
A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO)+c(HCO)+c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO)=c(HCO)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com