

分析 由流程可知,软锰矿的主要成分为MnO2,杂质金属元素Fe、Al等,加硫酸溶解后,发生SO2+MnO2═MnSO4,浸出液中阳离子主要有Mn2+、Fe2+、Al3+等,氧化”步骤发生MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入石灰浆调节pH,调节pH在3左右、温度控制在40℃左右,铁离子、铝离子转化为沉淀,过滤后,滤液蒸发浓缩、趁热过滤(防止低温MnSO4•H2O溶解而减少)制备MnSO4•H2O.
(1)加硫酸不引入新杂质;
(2)提高SO2的吸收效率,结合图可知需要的pH、温度;
(3)发生氧化还原反应,Mn元素的化合价降低,Fe元素的化合价升高;
(4)铁离子遇KSCN溶液为血红色;
(5)由①2Mn2++O2+4OH-=2MnO(OH)2(反应很快)、②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、③I2+2S2O32-=S4O62-+2I-可知存在O2~4 S2O32-,以此计算.
解答 解:(1)物质X最好选用硫酸,不引入杂质,故答案为:b;
(2)由图可知,提高SO2的吸收效率,酸浸适宜的条件为pH控制在3左右、温度控制在40℃左右,
故答案为:pH控制在3左右、温度控制在40℃左右;
(3)流程中“氧化”步骤主要反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)检验Fe3+是否除尽的最佳方法是取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽,
故答案为:取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽;
(5)n(S2O32-)=5.00×10-3mol•L-1×12.0 mL=6.00×10-5 mol,
O2~4 S2O32-
1 4
n(O2) 6.00×10-5 mol
n(O2)=$\frac{1×6.00×1{0}^{-5}mol}{4}$=1.50×10-5 mol,
水样中溶解氧的浓度为$\frac{1.5×1{0}^{-5}mol×32g/mol×1000mg/g}{0.1L}$=4.80 mg•L-1,
故答案为:4.80.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应及关系法计算的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质用蒸馏水溶解后,未冷却即转移至容量瓶中并定容 | |
| B. | 未洗涤溶解溶质用的烧杯及玻璃棒 | |
| C. | 定容时仰视刻度线观察液面 | |
| D. | 容量瓶中原来含有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 容量瓶容积 | 固体质量 | 实验操作 |
| A | 180mL | SrCl2:28.6g | 加入180mL水 |
| B | 200mL | SrCl2:31.8g | 配成200mL溶液 |
| C | 250mL | SrCl2:39.8g | 配成250mL溶液 |
| D | 250mL | SrCl2•2H2O:39.8g | 配成250mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
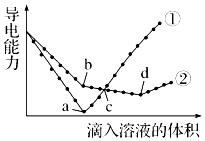 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | B. | b点,水电离产生的c(H+)<10-7mol/L | ||
| C. | c点,两溶液中含有相同量的 OH- | D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com