
A、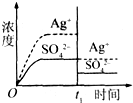 加入100mL蒸馏水 | B、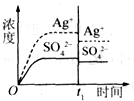 加入100mL 0.010mol?L-1 Ag2SO4 | C、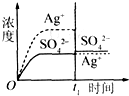 加入100mL 0.020mol?L-1 Na2SO4溶液 | D、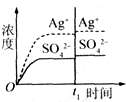 加入100mL 0.040mol?L-1 AgNO3溶液 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源:浙江省浙南、浙北部分学校2012届高三12月联考化学试题 题型:013
|
已知Ag2SO4的K sp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol/L).若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是 | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
查看答案和解析>>
科目:高中化学 来源:(教师解析专用)2009~2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了下图所示的实验装置。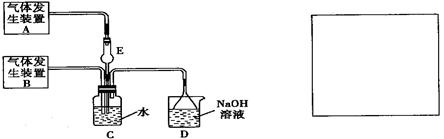
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是
;发生装置B应选择以下三种装置中的 (填序号)[来源:Z&xx&k.Com]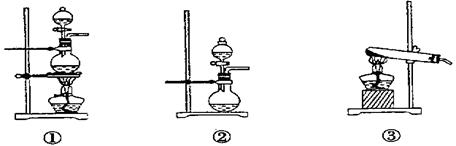
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式 。
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在 装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g) SO2Cl2(l) △H=" -" 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l) △H=" -" 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是 (填序号)
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
 10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。
10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。查看答案和解析>>
科目:高中化学 来源:2009-2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了下图所示的实验装置。

(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是
;发生装置B应选择以下三种装置中的 (填序号)[来源:Z&xx&k.Com]
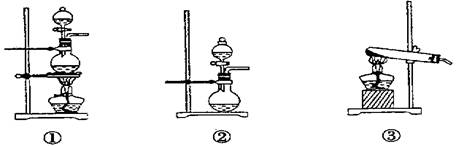
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式 。
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在 装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)  SO2Cl2(l)
△H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l)
△H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是 (填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com