
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
分析 A、2molNO与1molO2充分反应后生成2molNO2,而NO2中存在平衡:2NO2?N2O4;
B、用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则说明阳极上放电生成了0.1mol氧气;
C、Na2SO4和Na2HPO4的摩尔质量均为142g/mol,且两者均由2个阳离子和1个阴离子构成;
D、过氧化钠与水的反应中,氧元素的价态由-1价变为0价.
解答 解:A、2molNO与1molO2充分反应后生成2molNO2,而NO2中存在平衡:2NO2?N2O4,故反应后容器中分子个数小于2NA个,故A错误;
B、用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则说明阳极上放电生成了0.1mol氧气,故转移了0.4mol电子即0.4NA个,故B错误;
C、Na2SO4和Na2HPO4的摩尔质量均为142g/mol,故142g混合物的物质的量为1mol,且两者均由2个阳离子和1个阴离子构成,故1mol混合物中含2mol阳离子和1mol阴离子即3NA个离子,故C正确;
D、过氧化钠与水的反应中,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变小 | B. | 不变 | ||
| C. | 增大 | D. | 可能增大、减小,也可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


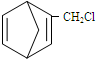 ,含共轭结构的原料可以是
,含共轭结构的原料可以是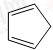 或
或 .(写结构简式)
.(写结构简式) 的合成路线(其他无机试剂任选).
的合成路线(其他无机试剂任选).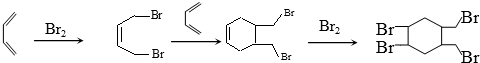 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
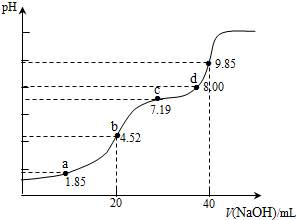
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(SO32-)=c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
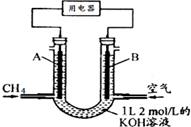 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据上述过程,每生成1molKMnO4,共转移6mol电子 | |
| B. | 第二步电解时,阳极电极反应式为2MnO42--2e-=2MnO4- | |
| C. | 第二步电解的离子方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+OH- | |
| D. | 第二步电解时阴极周围pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com