

分析 (1)反应中N元素化合价升高,被氧化,N2为氧化产物,Cl元素化合价降低;
(2)由方程式可知,当有3molCl2参加反应时,有2molNH3被氧化;
(3)反应8NH3+3Cl2═6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,该反应中转移6e-,以此来解答;
(4)由标准状况下的体积可计算氨气的物质的量,利用氨气的质量和溶液的体积来计算物质的量浓度,而体积可由溶液的质量和密度来计算.
解答 解:(1)反应中N元素化合价升高,被氧化,N2为氧化产物,Cl元素化合价降低,Cl2为氧化剂,故答案为:Cl2;N;
(2)由方程式可知,当有3molCl2参加反应时,有2molNH3被氧化,则参加氧化还原的氧化剂与还原剂的物质的量之比为3:2,故答案为:3:2;
(3)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(4)NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质;气体溶于水后,溶液的体积、密度均发生了改变,计算时应该用溶液质量除以密度求出其体积.设水的体积为1L,氨气的体积为700L,则氨气的物质的量为$\frac{700L}{22.4L/mol}$=31.25mol,
氨气的质量为:17g/mol×31.25molmol=531.25g,
1L水的质量约为1000g,则该氨水的质量分数为:$\frac{531.25g}{1000g+531.25g}$×100%≈34.7%,
该氨水的物质的量浓度为:c=$\frac{1000ρw}{M}$=$\frac{1000×0.9×34.7%}{17}$mol/L,故答案为:$\frac{1000×0.9×34.7%}{17}$mol/L.
点评 本题考查氧化还原反应的计算,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子的能量不变 | B. | 增加了活化分子的百分数 | ||
| C. | 降低了反应的活化能 | D. | 改变了化学反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: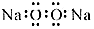 | B. | 次氯酸钠的结构式:H-Cl-OC | ||
| C. | 氯化铵的电子式: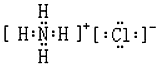 | D. | 硫离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 4 | 8 | 12 | 16 | 20 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com