
(16分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
① CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
② CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。

假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应②生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
A.c ( H2 )减少;
B.平衡常数K增大;
C.CH3OH 的物质的量增加;
D.正反应速率加快,逆反应速率减慢;
E.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用图装置模拟上述过程,

则: Co2+在阳极的电极反应式为: ;除去甲醇的离子方程式为 。
(16分)(1)+77.0 kJ/mol;(3分)(2)0.03(3分) ;(3)(4分)C、E;
(4)Co2+-e-= Co3+ (3分) 6Co3++CH3OH+H2O ==6Co2++CO2↑+6H+(3分)
【解析】
试题分析:①+②,整理可得:CH4(g)+H2O(g)=CH3OH (g)+H2(g) △H=+77.0 kJ/mol;(2)根据图像可知在100 ℃时达到平衡CH4的转化率是50%,所以根据方程式中物质之间的关系可知:平衡时H2的浓度是0.15mol/L,则用H2表示该反应的平均反应速率为V(H2)= 0.15mol/L÷5 min=0.03mol/(L·min);(3)A.平衡后压缩容器体积至原来的l/2,则物质的浓度都比原来大,平衡正向移动,是反应物的浓度有所减小,但是平衡移动的趋势是微弱的,所以c ( H2 )也增大,错误; B.由于平衡常数K只与温度有关,温度不变,化学平衡常数就不变,错误; C.增大压强,平衡正向移动,所以生成物CH3OH 的物质的量增加,正确;D.压缩容器的容积,则物质的浓度增大,所以正反应速率加快,逆反应速率也加快,错误; E.由于平衡正向移动,所以重新平衡c ( H2 )比原来的2倍小,而c (CH3OH )比原来的2倍大,因此c ( H2 )/ c (CH3OH )减小,正确;(4)根据题意可知: Co2+在阳极被氧化为Co3+,电极反应式为Co2+-e-= Co3+;Co3+将甲醇氧化成CO2和H+,根据电荷守恒、电子守恒和质量守恒定律可得反应的方程式是:6Co3++CH3OH+H2O ==6Co2++CO2↑+6H+。
考点:考查盖斯定律的应用、热化学方程式的书写、化学反应速率的计算、外界条件对平衡移动的影响、电解原理在废水处理中的应用的知识。


科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:选择题
对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v (W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
反应2A+3B=C+2D在2L的密闭容器中进行,半分钟后,C的物质的量增加了0.3 mol,则此反应的平均速率表达正确的是
A.v(C)=0.01 mol·L-1·s-1
B.v(B)=0.03 mol·L-1·s-1
C.v(A)=0.01 mol·L-1·s-1
D.v(D)=0.02 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:填空题
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l) △H<0
N2O3(l) △H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。

(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向______ _移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数。下列有关叙述正确的是(Fe-56 O-16)( )
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
B.5.6g Fe与足量稀盐酸反应,转移电子数为0.2 NA
C.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
D.18g重水(D2 O)所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:选择题
根据反应:S2O32-+2H+==SO2+S↓+H2O,下表各组实验最快出现浑浊的是
| Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | ||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | V(mL) | ||
A | 0.1 | 5 | 0.1 | 5 | 5 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:填空题
(16分)(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:甲醇脱水反应①2CH3OH(g) = CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g) = C2H4 (g)+2H2O(g)?△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g) = CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g) C2H5OH(g) △H= ;
C2H5OH(g) △H= ;
(2)乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图。结合曲线归纳平衡转化率-T曲线变化规律:
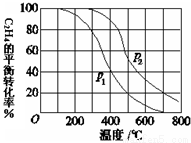
(a) ;
(b) ;
(3)若要进一步提高乙烯的转化率,可以采取的措施有 。
A.增大乙烯的浓度 B.分离出乙醇 C.加催化剂
(4)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,求x的值。(写出计算步骤)
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
下列分离、提纯、鉴别物质的方法正确的是
A. 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B. 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
在0.5 L溶液中含有0.1 mol NaCl和0.2 mol MgCl2,则此溶液中氯离子的物质的量浓度是
A、0.3 mol·L-1 B、0.5 mol·L-1
C、0.6 mol·L-1 D、1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com