
分析 (1)Fe基态原子外围电子排布式为3d64s2,铁原子失去4s上的2个电子变成Fe2+,Fe2+在基态时,价层电子排布式为3d6;
(2)羟胺(NH2OH)中N原子形成3个σ键,一个孤电子对,因此N采取sp3杂化,而O原子形成2个σ键,两个孤电子对;NH4Cl晶体中含有的化学键类型有离子键、极性键和配位键;
(3)同周期第ⅡA和第ⅤA的元素第一电离能大于相邻族元素,同周期从左到右电负性增强;
(4)NH3分子间存在氢键,所以沸点高于PH3;
(5)分子晶体熔沸点较低;
(6)铁为面心立方堆积,在铜晶胞中,铁原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,若铁晶体中一个晶胞的边长为a cm,则铁晶体的密度为$\frac{\frac{4M}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{4M}{{a}^{3}{N}_{A}}$g/cm3,由此解答.
解答 解:(1)Fe基态原子外围电子排布式为3d64s2,铁原子失去4s上的2个电子变成Fe2+,Fe2+在基态时,价层电子排布式为3d6,故答案为:3d6;ls22s22p63s23p63d6或[Ar]3d6(2分)
(2)羟胺(NH2OH)中N原子形成3个σ键,一个孤电子对,因此N采取sp3杂化,而O原子形成2个σ键,两个孤电子对,所以也是sp3杂化,NH4Cl晶体中含有的化学键类型有离子键、极性键和配位键,故答案为:N、O;ACD;
(3)同周期第ⅡA和第ⅤA的元素第一电离能大于相邻族元素,所以第一电离能N>O;同周期从左到右电负性增强,所以电负性O>N,故答案为:N>O;O>N;
(4)NH3分子间存在氢键,所以沸点高于PH3,故答案为:NH3分子间存在氢键;
(5)分子晶体熔沸点较低,该物质的熔沸点较低,所以为分子晶体,故答案为:分子;
(6)铁为面心立方堆积,在铜晶胞中,铁原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,若铁晶体中一个晶胞的边长为a cm,则铁晶体的密度为$\frac{\frac{4M}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{4M}{{a}^{3}{N}_{A}}$g/cm3,故答案为:$\frac{4M}{{a}^{3}{N}_{A}}$.
点评 本题主要考查了元素周期律、电负性、电离能、电子排布图、晶胞的计算等知识点,中等难度.


科目:高中化学 来源: 题型:选择题
| A. | Cl•在反应中是催化剂 | |
| B. | Cl•比Cl2更活泼 | |
| C. | ②也可能是Cl•(g)+CH4(g)→CH3Cl(g)+H•(g) | |
| D. | 由③可知C-Cl的键能比Cl-Cl的键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ Na+ NO3- Cl- | B. | Ba2+ Cu2+ NO${\;}_{3}^{-}$ Cl- | ||
| C. | SO42- SO3- NH4+ Na+ | D. | Mg2+ Na+ Br- ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
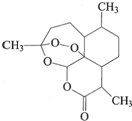 中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )
中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 易溶于乙醚等有机溶剂 | |
| C. | 可发生取代反应,不能发生氧化反应 | |
| D. | 在强酸或强碱性溶液中不能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2比O2的化学性质稳定 | B. | F2、Cl2、Br2、I2的沸点逐渐升高 | ||
| C. | 金刚石的熔点比晶体硅高 | D. | HF、HCl、HBr、HI的热稳定性依减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物:乙酸、软脂酸、硬脂酸 | B. | 同位素:氕、氘、氚 | ||
| C. | 同素异形体:金刚石、石墨、足球烯 | D. | 同分异构体:蔗糖、麦芽糖、葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B的结构简式
,B的结构简式 或
或 .
. ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com