
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
科目:高中化学 来源: 题型:
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。请根据上述信息回答:
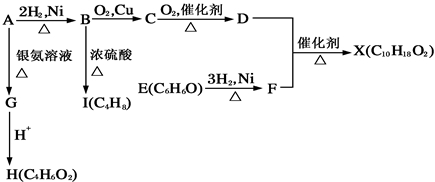
请回答下列问题:
(1)H中含氧官能团的名称是 。B→I的反应类型为 。
(2)只用一种试剂鉴别D、E、H,该试剂是 。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。
(4)D和F反应生成X的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+。现取等体积的两份溶液进行如下实验:
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336 mL。
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336 mL,该气体能使品红溶液褪色。
根据上述实验,下列推断正确的是( )
A. K+一定存在 B. Ag+和Cl-一定不存在
C. HCO3-一定不存在 D. 混合溶液中一定有0.015 mol SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1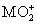 溶液中,恰好完全反应,则还原产物可能是( )
溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D. MO2+
查看答案和解析>>
科目:高中化学 来源: 题型:
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2A(g)+B(g)  2C(g),向容积为1 L的密闭容器中加入0.050 mol A和0.025 mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
2C(g),向容积为1 L的密闭容器中加入0.050 mol A和0.025 mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
a.v(C)=2v(B) b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”“减小”或“不变”);
(5)某温度下,A的平衡转化率(α)与体系总压强(p)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(a) K(b)(填“>”“<”或“=”)。
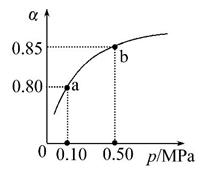
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于过氧化钠的叙述中,正确的是( )
A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B.1 mol Na2O2与H2O完全反应,转移2 mol电子
C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D.ag CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,我国的材料研究迅猛发展,出现了许多具有特殊功能的新型材料。
(1)硅是将太阳能转换为电能的常用材料,从硅的氧化物制取粗硅的化学方程式为______________________________________。
(2)化合物G是开发新一代汽车发动机的新材料。G的相对分子质量为140,含有硅元素,其质量分数为60%,另含有元素Y。E(含两种元素)与NH3反应制得G和HCl。G和E化学式分别为__________________________________ 。
常压条件下向G中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,化学通式可表示为Si6-xOxY8-x。在接近1 700℃时x的极限值约为4.0,则化合物中Y元素的化合价为 ____。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温被H2还原而得,已知铁酸盐(MFe2O4)高温还原时,发生反应的MFe2O4与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x= 。MFe2Ox中,+2价铁与+3价铁的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.离子化合物中一定不含共价键,共价化合物中一定不含离子键
B.含有离子键的化合物一定是离子化合物 C.含有共价键的物质一定是共价化合物
D.分子间作用力越大,分子的热稳定性就越大
| D | ||
| A | B | C |
| E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com