
【题目】水热法制备Fe3O4纳米颗粒的反应为 ![]() 下列说法正确的是( )
下列说法正确的是( )
A.将纳米Fe3O4颗粒分散在水中没有丁达尔现象
B.将纳米Fe3O4颗粒分散在水中,Fe3O4不能透过滤纸
C.每生成1molFe3O4 , 反应转移的电子为4mol
D.反应物OH﹣的化学计量数x=2
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】某液态卤代烃RX(R是烷基,X是某种卤素原子)的密度是a g/cm3。该RX在稀碱溶液中可以发生水解反应生成有机物ROH(ROH能与水互溶)和HX。为了测定RX的相对分子质量,进行了如下实验操作:
①准确量取该卤代烃bmL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀HNO3溶液酸化,滴加过量AgNO3溶液,得到白色沉淀。
④过滤、洗涤、干燥后称重,得到cg固体。
回答下列问题:
(1)步骤④中,洗涤的目的是为了除去沉淀上吸附的___________离子。
(2)该卤代烃中所含卤素的名称是____________,判断的依据是_________________。
(3)该卤代烃的相对分子质量是______________________(列出算式)。
(4)如果在步骤②中,加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c____(填写下列选项代码)。
A.偏大 B.偏小 C.不变 D.无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应在体积为2升的密闭容器中进行反应(A,B,C均为气体),在不同反应时间各物质的量的变化情况如图所示.则: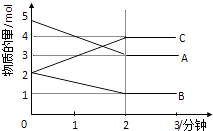
(1)该反应的化学方程为
(2)反应开始至2分钟,A的平均反应速率为
(3)反应开始至2分钟,A的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O含有的分子数是NA
B.常温常压下,NA个CO2占有的体积为22.4L
C.1.06克Na2CO3含有Na+数为0.02NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.已知白磷(P4)为正四面体形,12.4 g白磷中则含有共价键数为0.4 NA
B.3Fe+4H2O(g) ![]() ?Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移
?Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移
C.在0.1 mol/L碳酸钠溶液中Na+总数等于0.2 NA
D.电解精炼铜时,当电路中转移NA个电子时,阴极增重32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO ![]() 、SO
、SO ![]() 、Cl﹣、CO
、Cl﹣、CO ![]() 的某一种(1)若将四种盐分别溶于中水中,只有C盐溶液显蓝色.(2)若向四种溶液中分别加盐酸,B盐溶液中沉淀生成,D盐溶液中有无色无味的气体生成.根据以上事实,可推断:
的某一种(1)若将四种盐分别溶于中水中,只有C盐溶液显蓝色.(2)若向四种溶液中分别加盐酸,B盐溶液中沉淀生成,D盐溶液中有无色无味的气体生成.根据以上事实,可推断:
(1)A、B、C、D的化学式分别为:A、B、C、D、
(2)分别写出下列反应的离子方程式:A+DD与盐酸: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能源叙述不正确的是( )
A.大自然利用太阳能最成功的是植物的光合作用
B.H2是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
C.用植物秸秆制沼气是有效利用生物质能的方式之一
D.利用工业废气中的CO2制造全降解塑料,符合绿色环保要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: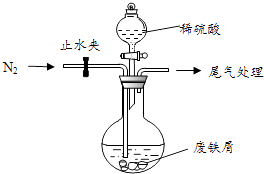
(1)【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备FeSO47H2O晶体,步骤如下:
①预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是 , 然后将废铁屑用水洗涤2~3遍.
②将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2 , N2的作用是 .
③再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为 .
④获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, , . 滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存.
(2)【测定FeSO47H2O含量】
①称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、胶头滴管、烧杯、量筒外,还需要的仪器有(填仪器名称)、 . 胶头滴管,250ml容量瓶…
②准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是 .
③用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO47H2O的质量分数为 . (已知Mr(FeSO47H2O)=278)
④若测量结果偏小,则可能是在定容时(填“俯视”或“仰视”)读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化铜(Ⅱ)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
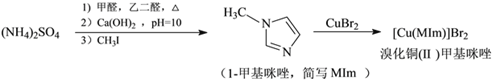
(1)铜元素位于周期表中第___族___区,基态Cu2+的核外电子排布式为______________。
(2)与NH4+互为等电子体的阴离子为__________________。
(3)MIm中碳原子杂化轨道类型为____________;1molMIm中含![]() 键数目为________ mol。
键数目为________ mol。
(4)一种铜的溴化物晶胞结构如图所示。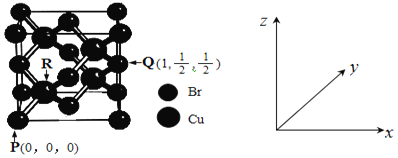
有关说法正确的是____________(填序号)。
a.该化合物的化学式为CuBr2 b.铜的配位数为8
c.与每个Br紧邻的Br有12个
d.由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(![]() ,
,![]() ,
,![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com