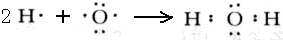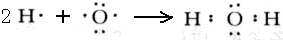【答案】
分析:X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数,XY
2是非极性分子,其晶体可用作人工降雨,则是CO
2,故X为碳元素,Y为氧元素;Y与Z同主族;则Z为硫元素.
(1)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对.
(2)Z的最高价氧化物对应水化物W是硫酸(H
2SO
4).
①在101kPa时,3.2g硫的物质的量为0.1mol,0.1mol硫单质完全燃烧可放出29.7kJ的热量,所以1mol硫单质完全燃烧可放出297kJ的热量,据此书写单质燃烧热的热化学方程式.注意书写热化学反应方程式,可燃物的物质的量为1mol.
②增大压强后,SO
2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗.
400℃~500℃作为操作温度,因为在这个温度范围内,催化剂的活性(反应速率)和SO
2的平衡转化率都比较理想.
③由于反应SO
3+H
2O=H
2SO
4是一个放热反应,如果用水或稀硫酸吸收SO
3,放出的热量会使溶液形成大量的酸雾,不利于SO
3的吸收,所以工业上用98.3%的浓硫酸吸收SO
3,然后在水或稀硫酸中稀释浓硫酸,制得各种浓度的硫酸产品.
(3)①碳与浓硫酸反应生成二氧化碳、二氧化硫、水.据此书写方程式.
②11.2L(标准状况)SO
2的物质的量0.5mol,催化剂作用下与CO发生化学反应,有2×6.02×10
23个电子转移时,根据电子转移守恒可知硫元素被还原到硫单质.
解答:解:X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数,XY
2是非极性分子,其晶体可用作人工降雨,则是CO
2,故X为碳元素,Y为氧元素;Y与Z同主族;则Z为硫元素.
(1)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为
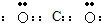
.
故答案为:
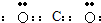
.
(2)Z的最高价氧化物对应水化物W是硫酸化学式为H
2SO
4.
①在101kPa时,3.2g硫的物质的量为0.1mol,0.1mol硫单质完全燃烧可放出29.7kJ的热量,所以1mol硫单质完全燃烧可放出297kJ的热量,硫单质燃烧热的热化学方程式S(s)+O
2(g)=SO
2(g);△H=-297kJ?mol
-1;
②增大压强后,SO
2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗.400℃~500℃作为操作温度,因为在这个温度范围内,催化剂的活性(反应速率)和SO
2的平衡转化率都比较理想.故选择400℃~500℃,1MPa大气压.故选B.
③由于反应SO
3+H
2O=H
2SO
4是一个放热反应,如果用水或稀硫酸吸收SO
3,放出的热量会使溶液形成大量的酸雾,不利于SO
3的吸收,所以工业上用98.3%的浓硫酸吸收SO
3,然后在水或稀硫酸中稀释浓硫酸,制得各种浓度的硫酸产品.故选C.
故答案为:H
2SO
4;S(s)+O
2(g)=SO
2(g);△H=-297kJ?mol
-1;B;C.
(3)①碳与浓硫酸反应生成二氧化碳、二氧化硫、水,反应方程式为C+2H
2SO
4(浓)
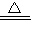
CO
2↑+2SO
2↑+2H
2O.
故答案为:C+2H
2SO
4(浓)
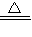
CO
2↑+2SO
2↑+2H
2O.
②11.2L(标准状况)SO
2的物质的量0.5mol,催化剂作用下与CO发生化学反应,有2×6.02×10
23个电子转移时,令硫元素在还原产物中的化合价为x,则0.5(4-x)=2,解得x=0,所以硫元素被还原为硫单质,反应方程式为SO
2+2CO
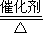
S+2CO
2.
故答案为:SO
2+2CO
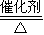
S+2CO
2.
点评:以元素推断为载体,考查性质与物质关系、电子式、热化学反应方程式、氧化还原反应、化学工业制备硫酸等,难度中等,推断元素是关键,是对所学知识的综合运用与学生能力考查.注意基础知识的掌握与灵活运用.

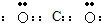 .
.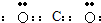 .
. CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O. CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O. S+2CO2.
S+2CO2. S+2CO2.
S+2CO2.