
【题目】饱和BaCO3溶液中存在平衡:BaCO3(s)![]() Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
A.加入少量0.1 mol·L-1盐酸B.加入少量硝酸钡固体
C.加入少量0.1 mol·L-1硫酸D.加入少量氢氧化钡固体
【答案】C
【解析】
A. 加入少量0.1 mol·L-1盐酸,氢离子会与CO32-发生反应,使平衡右移,Ba2+的物质的量浓度增大,故A可行;
B. 加入少量硝酸钡固体,硝酸钡溶于水使Ba2+浓度增大,虽然平衡会左移,但根据化学平衡移动原理可知Ba2+的物质的量浓度依然增大,故B可行;
C. 加入少量0.1 mol·L-1硫酸,硫酸会电离出氢离子和硫酸根,虽然氢离子会与CO32-发生反应,但BaSO4的溶解度比BaCO3更小,所以溶液中Ba2+的物质的量浓度会减小,故C不可行;
D. 加入少量氢氧化钡固体,氢氧化钡溶于水使Ba2+浓度增大,虽然平衡会左移,但根据化学平衡移动原理可知Ba2+的物质的量浓度依然增大,故D可行;
故答案为C。


科目:高中化学 来源: 题型:
【题目】一种以“火法粗炼”、“电解精炼”相结合的炼制精铜工艺流程如下,已知“还原”反应中,冰铜中的Cu2S先转化为Cu2O,然后Cu2O再与Cu2S反应生成粗铜。下列叙述正确的是
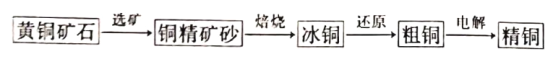
A. 该炼铜工艺对环境友好,不会产生大气污染物
B. “烙烧”过程中, CuFeS2既是氧化剂又是还原剂
C. 在Cu2S”还原”为Cu的总反应中,Cu2O作催化剂
D. “电解”时,金、银等贵金属被置换出来形成阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为___________,排布时最高能层的电子所占的原子轨道有__________个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法不正确的有_________。
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数可能为是4或6
D.Ni(CO)4中,镍元素是sp3杂化
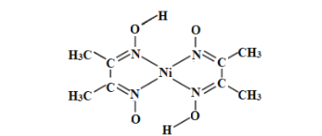
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“”表示出氢键。_____
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为_______,NiO熔点比NaCl高的原因是_______________________。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。合金LaNix晶体属六方晶系如图a所示,其晶胞如图a中实线所示,如图b所示(其中小圆圈代表La,小黑点代表Ni)。储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图c、d,这些就是氢原子存储处。
”),见图c、d,这些就是氢原子存储处。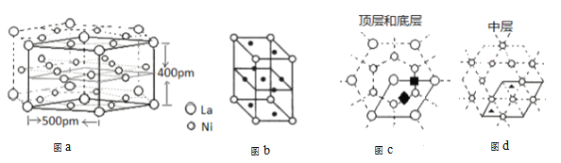
①LaNix合金中x的值为_____;
②LaNix晶胞的密度是________g/cm-3(阿伏伽德罗常数用NA表示,LaNix的摩尔质量用M表示 )
③晶胞中和“![]() ”同类的八面体空隙有______个。
”同类的八面体空隙有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是用于制备药品盐酸祛炎痛的中间产物,已知其合成路线如下:
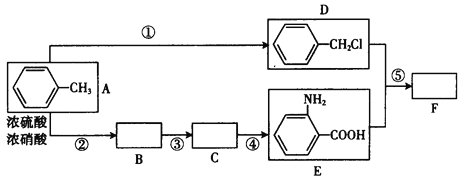
Ⅰ.RNH2+![]() CH2Cl
CH2Cl![]() RNHCH2
RNHCH2![]() +HCl(R和
+HCl(R和![]() 代表烃基)
代表烃基)
Ⅱ.苯的同系物易被高锰酸钾溶液氧化如下:
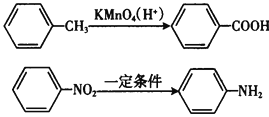
Ⅲ.苯胺具有弱碱性,易氧化。
回答下列问题:
(1)写出反应①的反应物质和条件_____________,B中所含官能团的名称_____________,C的结构简式__________________。
(2)D+E→F的化学方程式:______________。
(3)E的一种同分异构体(对位氨基)在一定条件下,可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程式__________________。
(4)写出D的含有苯环的同分异构体,已知该核磁共振氢谱图有3种不同类型的氢原子,峰面积之比为3 :2 :2,则该物质是______________(写结构简式)。
(5)反应①~⑤中,属于取代反应的是(填反应序号)________________,反应③的反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定量混合气体发生反应xA(g)+yB(g)![]() pC(g)+qD(g),平衡时测得B的浓度为1.0 mol·L-1。保持温度不变,将容器的体积压缩到原来的一半,再次达到平衡时,测得B的浓度为1.5 mol·L-1。下列有关判断正确的是
pC(g)+qD(g),平衡时测得B的浓度为1.0 mol·L-1。保持温度不变,将容器的体积压缩到原来的一半,再次达到平衡时,测得B的浓度为1.5 mol·L-1。下列有关判断正确的是
A.x+y<p+qB.气体的平均摩尔质量增大
C.压缩体积时,平衡向逆反应方向移动D.体系中混合气体的平均密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式____,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=____,气体V=____。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为____,若有2mol氯气参与该反应,则此时转移的电子数为____NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为____。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为____。
(5)葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为____g(请保留两位小数)。
9 | 白球比 | 1.6 | |
10 | 乳酸脱氢酶 | 161 | U/L |
11 | 磷酸肌酸激酶 | 56 | U/L |
12 | 甘油三酯 | 0.52 | mmol/L |
13 | 总胆固醇 | 4.27 | mmol/L |
14 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L |
15 | 低密度脂蛋白胆固醇 | 1.40 | mmol/L |
16 | 葡萄糖 | 4.94 | mmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
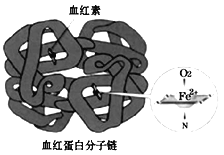
【题目】铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官。铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。
(1)(铁元素的分离) 称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。在坩埚中高温灼烧黑木耳,使之完全灰化。用酸充分浸泡溶解,过滤,滤液备用。
① 浸泡液检测不出铁元素的原因是____。
② 滤液中铁元素的存在形式是Fe2+、____。
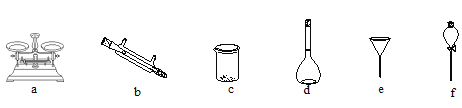
(2)(配制溶液) 将滤液配制成100 mL 溶液。实验时需要选择合适的仪器完成(铁元素的分离)、(配制溶液)2个实验,下列仪器不必使用的是____。
(3)(铁元素含量测定) 研学小组提出如下测量方案:
Ⅰ. 沉淀法:向溶液中加入足量NaOH溶液,搅拌使Fe(OH)2全部转化为Fe(OH)3然后过滤、洗涤沉淀、加热烘干、称量Fe(OH)3的质量进行分析。请指出该测量方案是否可行及其理由____。
Ⅱ. 比色法:流程示意如下:
![]()
① 用离子方程式解释加入H2O2的目的是____。
② 溶液a的颜色是____。
③ 溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量____(填“偏大”或“偏小”)。
(4)亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。可见,氧化还原反应能否发生与___有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )

A.气体A是NO2
B.X溶液中肯定存在Fe2+、Al3+、![]() 、
、![]()
C.溶液E和气体F不能发生化学反应
D.X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
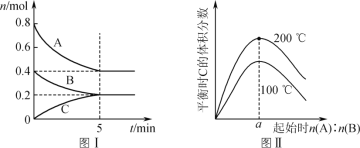
A.200 ℃时,反应达平衡时的平均速率v(B)=0.002 mol·(L·min)-1
B.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com