
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钴的一种核素 | B. | 质子数为27 | C. | 核外电子数为27 | D. | 中子数为60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Cu+Fe 3+ | |
| B. | 铜与稀硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
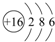 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
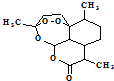 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).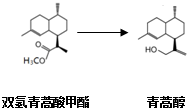
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com