
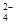 的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )| A.当消耗13克Zn时, 得到的还原产物为0.25mol |
| B.当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ |
| C.反应中最多有两种单质生成 |
| D.反应结束时,可得到0.25molZnSO4 |
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.赤铁矿的主要成分是Fe3O4 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
| D.常温下,将铁钉投入浓硝酸中可生成Fe(NO3)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若金属有剩余,在溶液中再滴入硫酸后,金属不溶解 |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| |
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓硫酸 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
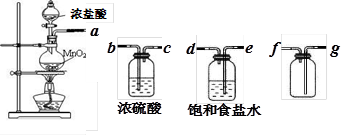
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | | 固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.b >0.3a | B.b <0.2a | C.0.2a<b <0.3a | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.8g | B.5.6g | C.11.2g | D.1.4g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
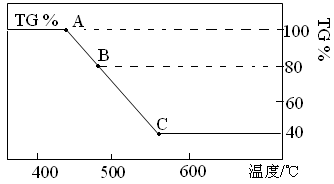
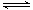 Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com