
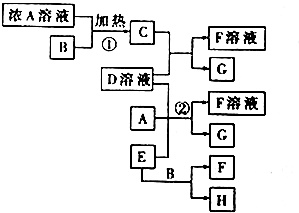
分析 实验室中,常用固体E在B的催化下加热制取气体单质H,则可推断知E为氯酸钾,B为二氧化锰,H为氧气,G为紫黑色固体单质,可推断G为碘单质,A的浓溶液与B加热生成C,可推得C物质为氯气,则A为盐酸,反应C和D溶液反应生成F溶液和G,则D为碘化钾,F为氯化钾,据此答题.
解答 解:实验室中,常用固体E在B的催化下加热制取气体单质H,则可推断知E为氯酸钾,B为二氧化锰,H为氧气,G为紫黑色固体单质,可推断G为碘单质,A的浓溶液与B加热生成C,可推得C物质为氯气,则A为盐酸,反应C和D溶液反应生成F溶液和G,则D为碘化钾,F为氯化钾,
(1)上述分析可知A、E、F、G的化学式分别为:HCl、KClO3、KCl、I2,故答案为:HCl;KClO3;KCl;I2;
(2)反应①为实验室制氯气的反应,反应的化学方程式为4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2 +Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2 +Cl2↑+2H2O;
(3)反应②为氯酸钾在酸性条件下氧化碘化钾,反应的离子方程式为6I-+ClO3-+6H+=3I2+Cl-+3H2O,
故答案为:6I-+ClO3-+6H+=3I2+Cl-+3H2O;
(4)实验室可以用双氧水分解制氧气,反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
点评 本题主要考查氯及其化合物的知识,题目难度中等,物质的推断是解题的关键,答题时注意根据物质的颜色和反应的特征进行物质推断.


科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液,出现红色,一定不含Fe2+ | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| D. | 玻璃、水泥、陶瓷、刚玉都是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01g | B. | 0.02g | C. | 0.14g | D. | 0.17g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
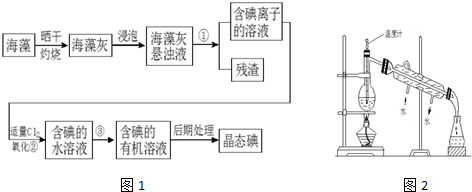
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
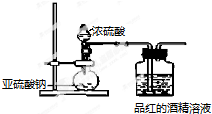
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| A | Cl2 | SO2 | Ba(NO3)2 |
| B | HCl | CO2 | 石灰水 |
| C | NH3 | SO2 | Ba(OH)2 |
| D | NO2 | SO2 | BaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3•H2O+H3O+ | |
| B. | 将16.8g铁粉投入100mL4.0mol/L的HNO3溶液中(还原产物只有NO):6Fe+20H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O | |
| D. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com