
| A. | a×b×18×6.02×1023 | B. | $\frac{18b}{a}$×6.02×1023 | ||
| C. | $\frac{18a}{b}$×6.02×1023 | D. | $\frac{b}{18a}$×6.02×1023 |
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| D. | O2的摩尔体积约为22.4L.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
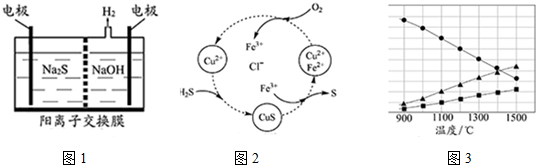
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 编号 | a | b | c |
| A | Na | Na2O | NaOH |
| B | Al2O3 | NaAlO2 | Al(OH)3 |
| C | CO2 | Na2CO3 | NaHCO3 |
| D | Fe | FeCl3 | Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2都是钠的氧化物,都是碱性氧化物 | |
| B. | Na2O、Na2O2都是易溶于水(与水反应)的白色固体 | |
| C. | Na2O2在和CO2的反应中既是氧化剂又是还原剂 | |
| D. | Na2O2与水反应时,1mol Na2O2转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com