
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )
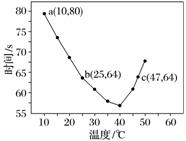
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知:pM=-lg c(M),p(CO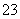 )=-lg c(CO
)=-lg c(CO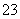 )。下列说法正确的是( )
)。下列说法正确的是( )
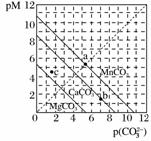
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO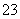 )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO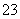 )
)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO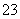 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
N2在诸多领域用途广泛。某化学兴趣小组为探究在实验室制备较为纯净N2的方法,进行了认真的准备。请你参与交流与讨论。
[查阅资料]N2的制法有下列三种方案:
方案1:加热NaNO2和NH4Cl的浓溶液制得N2。
方案2:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉。
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2。
[实验准备]以实验室常见仪器(药品)等设计的部分装置如下图(部分夹持和加热仪器未画出)。
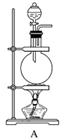
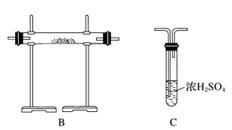

[分析交流]
(1)若以方案1制得N2,应选择的发生装置是___________________________。
(2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的连接顺序是______________(填字母)。获得N2的反应原理是________________________________________________________________________(写反应方程式)。
(3)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气法,其原因是________________________________________________________________________。
你提出的收集方法是______________________________________。
(4)上述三个方案中,制得的N2纯度最差的是________。在N2纯度要求不甚严格的情况下,有人建议将方案2和方案3结合使用,你认为其优点是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1 min后,测得容器内A的浓度为x mol·L-1。这时B的浓度为______ mol·L-1,C的浓度为______ mol·L-1。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移________mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥__________________________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
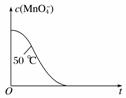
v(KMnO4)=________
mol·L-1·min-1。
(4)已知50 ℃时c(MnO )~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO
)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO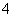 )~t的变化曲线示意图。
)~t的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中能量变化如图所示,下列有关叙述正确的是( )
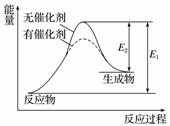
A.该反应为放热反应
B.催化剂改变了化学反应的热效应
C.催化剂不改变化学反应过程
D.催化剂改变了化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如下图所示,判断下列说法正确的是( )
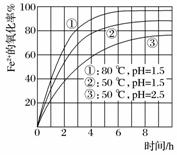
A.pH越小氧化率越大
B.温度越高氧化率越小
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO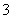 、CO
、CO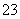 、ClO-结合H+的能力由强到弱的顺序为____________。
、ClO-结合H+的能力由强到弱的顺序为____________。
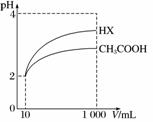
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重晶石矿的主要成分为硫酸钡,纯净的硫酸钡才能供医用作“钡餐”。硫化钡是可溶于水的盐。讨论用重晶石矿制硫酸钡,设计流程如下:

写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。为进行反应②先要分离出硫化钡,采用的方法是 。反应前要在溶液中滴入少量Ba(OH)2溶液,其作用是: 。
(2)若B物质在该生产过程中可循环使用,则反应③的化学方程式是: 。
(3)有人提出反应②产生了有臭鸡蛋气味的有毒气体,可采用改变反应物的方法避免产生该气体,则反应②的化学方程式是: 。此时若要B物质还能循环使用,则C为 (写化学式)。BaSO4是因为具有 、 等性质而可用作“钡餐”。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com