
 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:
,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题: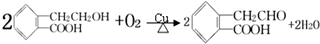 ,
,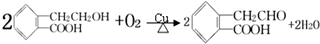 .
.


科目:高中化学 来源: 题型:
| 加硫酸的序号 | 加入硫酸的体积m/L | 剩余固体的质量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
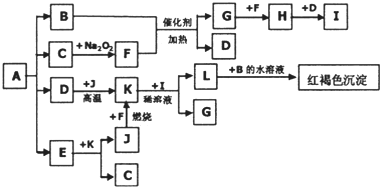
查看答案和解析>>
科目:高中化学 来源: 题型:
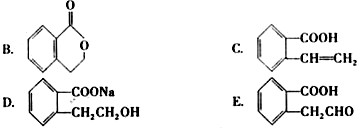
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | N中不含 |
| ② |
确定M溶液中含有Na+,不含K+ |
③用pH试纸检测M溶液,pH试纸呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
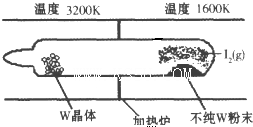 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.| 1 |
| 2 |
c(S
| ||
c(HS
|
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com