

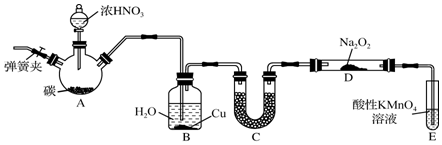
分析 (1)A装置能自发的进行氧化还原反应,所以为原电池,B装置为电解池;
(2)原电池中锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,根据溶液中氢离子浓度变化判断pH变化;
(3)C 装置为铁的吸氧腐蚀装置,则碳电极为氧气得电子发生还原反应生成氢氧根离子,遇酚酞变红;
(4)根据串联电路中转移电子相等进行计算.
解答 解:(1)A装置能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B装置有外接电源,属于电解池,故答案为:原电池;电解池;
(2)锌为负极,电极反应式Zn-2e-═Zn2+,铜为正极,铜极上的电极反应式为Cu2++2 e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,石墨棒C2附近还生成氢氧根离子,导致溶液碱性增强,则溶液的pH增大,酚酞遇碱变红色,所以石墨棒C2附近发生的实验现象是:有气体生成、溶液变红色,
故答案为:负;Zn-2e-═Zn2+;阳;2Cl--2e-=Cl2↑;有无色气泡产生附近溶液变红色;
(3)C 装置为铁的吸氧腐蚀装置,则碳电极为氧气得电子发生还原反应生成氢氧根离子,遇酚酞变红,则电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)C2极析出的气体是氢气,氢气的物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,原电池中锌作负极而被腐蚀,所以随着反应的进行,锌的质量逐渐减少,生成0.01mol氢气转移电子的物质的量=0.01mol×2=0.02mol,根据串联电路中转移电子相等知,锌减少的质量=$\frac{0.02mol}{2}$×65g/mol=0.65g,在原电池中,锌作负极、Cu作正极,正极电极反应式为Cu2++2e-=Cu,转移0.02mol电子,析出0.64gCu,所以溶液质量增加0.01g,
故答案为:0.01.
点评 本题考查了原电池和电解池原理,根据反应的自发性确定原电池和电解池,再结合各个电极上发生的反应来分析解答,难点是电极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图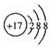 | |
| B. | S2-的结构示意图: | |
| C. | 纯碱的化学式:NaHCO3 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 营养液所含成分 | 质量(g) |
| KCl | a |
| K2SO | b |
| NH4Cl | 428 |
| A. | 53.5 和214 | B. | 74.5 和348 | C. | 74.5 和696 | D. | 149 和696 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
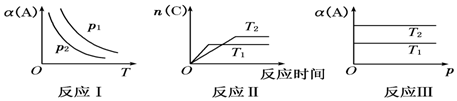
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列说法正确的是
A.2.3g钠由原子变成离子时,失去的电子数目为0.2NA
B.0.2NA个硫酸分子与19.6g磷酸分子含有相同的氧原子数
C.28g氮气所含原子数为NA
D.NA个氧分子与NA个氢分子的质量比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com