
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.将11.2LCl2通入足量的NaOH溶液中充分反应,转移的电子数为0.5NA
B.常温下,1.0LpH=1的H2SO4溶液中含有H+的数目为0. 2NA
C.4.4 g由CO2和N2O组成的混合气体中含有的电子总数为2.2NA
D.11.5 g乙醇分子中含有C-H键的数目为1.5NA
科目:高中化学 来源: 题型:
【题目】有一种线性高分子,结构如下图所示。
![]()
下列有关说法正确的是( )
A. 该高分子由4种单体缩聚而成
B. 构成该高分子的单体中有2种羧酸
C. 上述单体中的乙二醇,可被O2催化氧化生成单体之一的草酸
D. 该高分子有固定熔、沸点,1 mol上述链节完全水解需要氢氧化钠物质的量为 5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是

A.W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1 mol·L-1
C.pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D.pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+ c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)国外学者提出的由CO2制取C的太阳能工艺如图所示:
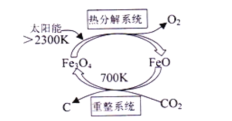
①“热分解系统”发生的反应为2Fe3O4![]() 6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为 ___________ 。
6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为 ___________ 。
②“重整系统”发生反应的化学方程式为____________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) △H,不同温度下平衡时的四种气态物质的物质的量如图所示:
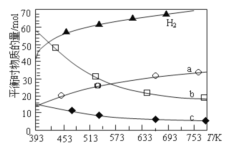
①曲线b表示的物质为 _______ (写化学式)。
②该反应的△H ________0 (填:“>” 或“<”)。
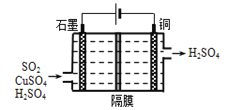
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2n)H2O═2n CuSO4+(2-2n)H2SO4。从环境保护的角度看,催化脱硫的意义为____;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为 _____g
②利用如图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂化验员检验某含有KBrO3、KBr及惰性物的样品。化验员称取了该固体样品1.000 g,加水溶解后配成100 mL溶液X。
Ⅰ. 取25.00 mL溶液X,加入稀硫酸,然后用Na2SO3将BrO![]() 还原为Br-;
还原为Br-;
Ⅱ. 去除过量的SO![]() 后调至中性;
后调至中性;
Ⅲ. 加入K2CrO4作指示剂,用0.100 0 mol·L-1AgNO3标准溶液滴定Br-至终点,消耗 AgNO3标准溶液11.25 mL;
Ⅳ. 另取25.00 mL溶液X,酸化后加热,再用碱液调至中性,测定过剩Br-,消耗上述AgNO3标准溶液3.75 mL。
已知:①25 ℃时,Ag2CrO4(砖红色)的Ksp=1.12×10-12,AgBr(浅黄色)的Ksp=5.0×
10-15;
②Ⅳ中酸化时发生反应:BrO![]() +5Br-+6H+=== 3Br2+3H2O
+5Br-+6H+=== 3Br2+3H2O
请回答:
(1)步骤Ⅰ中,反应的离子方程式为________________________________。
(2)步骤Ⅲ中,滴定终点的现象为_____________________________________________。
(3)步骤Ⅳ中,加热的目的是________________________。
(4)计算试样中KBrO3质量分数。(写出计算过程,结果保留3位有效数字)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1molL-1的H3PO2溶液和1molL-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示。下列说法错误的是
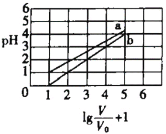
A.常温下,NaBF4溶液的pH=7
B.常温下,H3PO2的电离平衡常数约为1.1![]() 10-2
10-2
C.NaH2PO2 溶液中:c(Na+) =c( H2PO2- ) +c( HPO22-) +c(PO23-) +c( H3PO2)
D.常温下,在0≤pH≤4时,HBF4溶液满足![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的8种元素,完成下列小题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素①的元素符号是__________, 元素⑤的原子结构示意图为____________。
(2)元素②的简单氢化物的化学式为__________,此氢化物遇元素⑧的氢化物时,会产生大量的____________(填现象)
(3)题目所给的8种元素中,金属性最强的元素是___________(填元素名称),非金属性最强的元素是_______(填元素名称),最高价氧化物对应水化物具有两性的是_______(填化学式,下同),最高价氧化物对应水化物碱性最强的是________,元素②和③的简单氢化物较稳定的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径与原子序数的关系如下图,下列说法错误的是( )
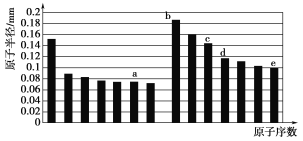
A. a、e两种元素的气态氢化物的沸点相比,前者较高
B. c、e两种元素的离子半径相比,前者较小
C. 由a与d两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. c的氧化物能溶于b的氢氧化物的水溶液和e的氢化物的水溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com