
| 物质 | 试剂 | 分离方法 | |
| ① | KNO3(NaCl) | 蒸馏水 | 降温结晶 |
| ② | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有 ④ | D. | ③④ |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法确定 | B. | 升高 | C. | 不变 | D. | 降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个主族7个周期 | |
| B. | 原子最外电子层只有2个电子的元素可能是金属元素也可能是非金属元素 | |
| C. | 在元素周期表中位于金属元素和非金属元素交界处最容易找到耐高温耐腐蚀的合金材料 | |
| D. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
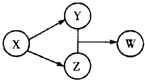 X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是
X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是 | A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al2O3 |
| Y | FeCl2 | NaOH | CO2 | AlCl3 |
| Z | Cl2 | Na2CO3 | CaCO3 | NaAlO2 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com