
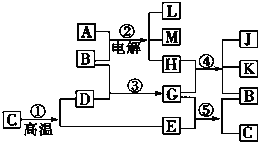
 根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.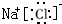
分析 由题意可知,反应①是工业上生产化合物D的反应,常见的是高温分解石灰石的反应,C为CaCO3,D为CaO,E为CO2.再由⑤是实验室鉴定E的反应,可知G为Ca(OH)2,B为H2O.则反应②是电解饱和食盐水:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,K、J混合固体应为漂白粉,结合物质的相关性质以及题目要求可解答该题.
解答 解:反应①是工业上生产化合物D的反应,常见的是高温分解石灰石的反应,C为CaCO3,D为CaO,E为CO2.再由⑤是实验室鉴定E的反应,可知G为Ca(OH)2,B为H2O.则反应②是电解饱和食盐水:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,K、J混合固体应为漂白粉,
(1)由以上分析可知L为H2,A为NaCl,的电子式为: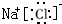 ,故答案为:H2;
,故答案为:H2;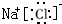 ;
;
(2)反应②是电解饱和食盐水,方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,④为制漂白粉的反应,
方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:②;④;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
(3)E和K、J混合溶液反应的化学方程式为2Ca(OH)2+CO2=CaCO3↓+2HClO,符合强酸制取弱酸的原理,说明酸性H2CO3>HClO,
故答案为:2Ca(OH)2+CO2=CaCO3↓+2HClO;酸性H2CO3>HClO;
(4)K、J混合固体应为漂白粉,a.漂白粉中加少量浓盐酸,与盐酸反应生成 氯气,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,反应现象为有黄绿色气体产生,b.漂白粉中加入FeCl2溶液中,亚铁离子被氧化成铁离子,溶液变为棕黄色,
故答案为:黄绿色气体产生;溶液变为棕黄色;ClO-+Cl-+2H+=Cl2↑+H2O.
点评 本题综合考查元素化合物知识,难度较大,要注意充分利用反应条件等信息,打开“突破口”,特别要注意常见工业生产.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| B. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 用石墨电极电解Cu(NO3)2溶液,当转移电子数为0.2NA时,阴极析出6.4g金属 | |
| D. | 常温下含有NA个NO2、N2O4分子的混合气体,温度降至0℃,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
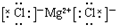 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据能量守恒定律,反应物能量之和等于生成物能量之和 | |
| B. | 化学反应一定伴随能量变化,有能量变化也一定伴随化学反应 | |
| C. | 反应物所具有的总能量比生成物所具有的总能量高的反应是放热反应 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ②③④⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com