
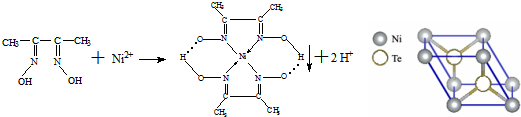
 .
.分析 (1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+,根据构造原理书写基态Ni2+的核外电子排布式;
(2)同一周期中,元素的电负性随着原子序数的增大而增大;
(3)利用均摊法确定其化学式;
(4)分子晶体的熔沸点较低;
(5)价电子数相等、原子个数相等的微粒为等电子体;
(6)双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;-OH之间可以形成氢键.
解答 解:(1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+,根据构造原理知,基态Ni2+的核外电子排布式为1s22s22p63s23p63d8(或[Ar]3d8),故答案为:1s22s22p63s23p63d8(或[Ar]3d8);
(2)同一周期中,元素的电负性随着原子序数的增大而增大,所以C、N、O三种元素的电负性大小顺序为:O>N>C;
故答案为:O>N>C;
(3)该晶胞中镍原子个数=8×$\frac{1}{8}$,Te原子个数=2,则该晶胞中镍和碲原子个数之比为1:2,则其化学式为:NiTe2,
故答案为:NiTe2;
(4)分子晶体的熔沸点较低,所以该物质为分子晶体;
故答案为:分子晶体;
(5)由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式为 ;
;
故答案为: ;
;
(6)①双键是由一个σ键和一个π键构成,分子中存在C=N,所以碳氮之间的共价键类型是σ键、π键;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;
故答案为:σ键、π键;配位键;
②分子中存在-OH,-OH之间可以形成氢键;
故答案为:氢键.
点评 本题考查了物质结构和性质,涉及等电子体、原子的杂化方式、晶体的计算、核外电子排布式的书写等知识点,会根据均摊法确定物质的化学式、根据价层电子对互斥理论确定原子杂化方式及分子空间构型,难度中等.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 氯化铵溶液中加入稀NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | 将少量的氯气通入溴化亚铁溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 碳酸氢钠固体和稀盐酸反应:NaHCO3+H+═Na++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2、H2SO4 | B. | Mg(OH)2、H2SO4 | C. | KOH、HCl | D. | Al(OH)3、H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
| D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的组成都含有C、H、O、N等元素 | |
| B. | 在一定条件下,都能发生水解反应 | |
| C. | 蛋白质和氨基酸一样具有两性 | |
| D. | 淀粉溶液中加稀硫酸加热水解后,加入新制银氨溶液加热可以产生银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的摩尔体积约为22.4 mol•L-1 | |
| B. | 标准状况下9gH2O体积约为11.2L | |
| C. | 在100 mL水中溶解5.85 g NaCl,则所得NaCl溶液的物质的量浓度为1 mol•L-1 | |
| D. | 同温同压下,相同体积的任何气体所含物质分子的物质的量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数)
如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 | |
| A | H2SO4 | CH3COOH | NO2 | Na2O |
| B | BaSO4 | HClO | Mn2O7 | CaO |
| C | NaCl | 氨水 | SO2 | MnO2 |
| D | HI | HF | CO2 | Fe3O4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com