
【题目】碲是当代高科技材料不可缺少的重要组成元素。以铋碲矿(主要含Te、Bi、Si、S等元素)为原料生产精碲的工艺流程如下:
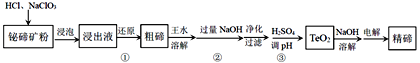
已知:TeO2是两性氧化物,微溶于水.回答下列问题:
(1)浸出液中碲以TeO2+存在,步骤①加入Na2SO3进行还原,反应的离子方程式为________。Na2SO3的实际用量比理论用量偏多,其主要原因是________。
(2)王水是由约3体积浓盐酸和约1体积浓硝酸配制而成。在实验室中配制王水所用的玻璃仪器除玻璃棒外还有________。王水溶解粗碲时,加入的碲粉与生成的NO的物质的量之比为________。
(3)粗碲中仍含有硅元素,净化时加入CaCl2溶液可以除去硅元素,硅元素将以________(填化学式)形式被除去。
(4)步骤③,将Na2TeO3转化为TeO2,反应的离子方程式是________。
(5)电解时,精碲在______极析出,电解产物中可循环使用的是________。
【答案】TeO2++2SO32-+H2O=Te↓+2SO42-+2H+ Na2SO3与盐酸反应产生SO2 (或与浸出液中其他氧化性物质反应) 量筒和烧杯 3:4 CaSiO3 TeO32-+2H+=TeO2↓+H2O 阴 NaOH
【解析】
(1) 碲以TeO2+存在,步骤①加入Na2SO3进行还原,发生氧化还原反应生成粗碲、硫酸根离子,并用电荷守恒配平;浸泡时,用HCl、NaClO3过量,加入亚硫酸钠时会发生化学反应;
(2) 实验室配制王水时,量取盐酸、硝酸的体积用量筒,配制时在烧杯中,搅拌使用玻璃棒;王水溶解粗碲时,反应的离子方程式为3Te+4H++4NO3-=3TeO2+4NO↑+2 H2O;
(3)粗碲中仍含有硅元素,且以硅酸根离子的形式存在;
(4)步骤③,通过调节pH,将Na2TeO3转化为TeO2;
(5) TeO2是两性氧化物,加入NaOH时,以TeO32-形式存在,电解时,Te的化合价降低,得电子生成氢氧根离子、Te。
(1) 碲以TeO2+存在,步骤①加入Na2SO3进行还原,发生氧化还原反应生成粗碲、硫酸根离子,并用电荷守恒配平,离子方程式为TeO2++2SO32-+H2O=Te↓+2SO42-+2H+;浸泡时,用HCl、NaClO3过量,加入亚硫酸钠时会发生化学反应,导致Na2SO3的实际用量比理论用量偏多;
(2) 实验室配制王水时,量取盐酸、硝酸的体积用量筒,配制时在烧杯中,搅拌使用玻璃棒;王水溶解粗碲时,反应的离子方程式为3Te+4H++4NO3-=3TeO2+4NO↑+2 H2O,碲粉与生成的NO的物质的量之比为3:4;
(3)粗碲中仍含有硅元素,且以硅酸根离子的形式存在,加入CaCl2溶液时可生成硅酸钙沉淀;
(4)步骤③,通过调节pH,将Na2TeO3转化为TeO2,反应的离子方程式为TeO32-+2H+=TeO2↓+H2O;
(5) TeO2是两性氧化物,加入NaOH时,以TeO32-形式存在,电解时,Te的化合价降低,得电子,则在阴极产生;同时生成氢氧根离子,则可循环使用物质为NaOH。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物H具有似龙延香、琥珀香气息,香气淡而持久,广泛用作香精的稀释剂和定香剂.合成它的一种路线如图:
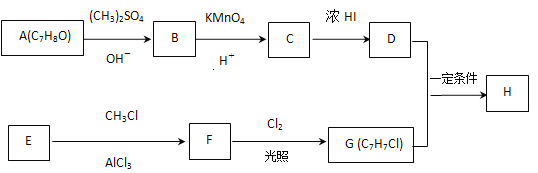
已知以信息:
①![]() ;
;
②核磁共振氢谱显示A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,溶液呈紫色;
④芳香烃 F的相对分子质量介于90~100之间,0.1 mol F充分燃烧可生成7.2 g水;
⑤R1COOH+RCH2Cl![]() R1COOCH2R+HCl。
R1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是____,由C生成D的反应的化学方程式为______________。
(2)由F生成G的反应的化学方程式为____________,反应类型为____。
(3)H的结构简式为_________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有 (不考虑立体异构)_____种,其中核磁共振氢谱中有5组峰,且峰面积之比为1∶2∶2∶2∶1的同分异构体的结构简式是________(任写一种即可)。
(5)由苯酚和已有的信息经以下步骤可以合成化合物
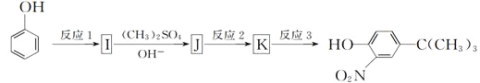
反应1所用的试剂为___,K的结构简式为____,反应3所用的试剂为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若1mol有机物A能与1mol氢气发生加成反应,其加成产物是2,2,3-三甲基戊烷,则此有机物A可能的结构简式有___________。
(2)若1mol有机物A与2molH2发生加成反应,其加成产物为2,2,3-三甲基戊烷,则此有机物A可能的结构简式为______(注意:![]() 不稳定)。
不稳定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T细胞淋巴瘤,其合成路线如图所示:
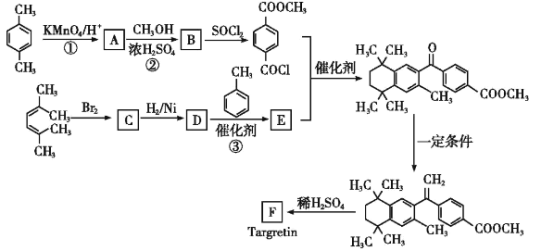
已知:
ⅰ.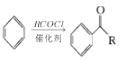
ⅱ.![]()
ⅲ.RCOOH![]() RCOCl(R表示烃基)
RCOCl(R表示烃基)
(1)反应①的反应类型是__。
(2)反应②的化学方程式:__。
(3)C的核磁共振氢谱图中有__个峰。
(4)反应③的化学方程式:__。
(5)F的分子式是C24H28O2。F中含有的官能团:__。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构):__。
结构):__。
a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(7)已知:![]() (R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然油脂A的分子式为C57H106O6。1mol该油脂完全水解可得到1mol甘油、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为N(C):N(H):N(O)=9:16:1。
(1)写出B的分子式:__。
(2)写出C的结构简式:__,C的名称是__。
(3)写出含5个碳原子的C的同系物可能的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,醢藏着丰富的化学元素,如氯、溴、碘等,海洋资源的综合利用具有非常广阔的前景。
(1)下列说法正确的是_________。
a.AgCl、AgBr、AgI的颜色依次变深 b.F、Cl、Br、I的非金属性依次增强
c.HF、HCl、HBr、HI的还原性的依次增强 d.F2、Cl2、Br2、I2与H2化合由难变易
(2)实验室从海藻灰中提取少量碘的流程如下图:
![]()
①氧化时,可以加入MnO2在酸性条件下进行氧化,反应的离子方程式为:_________。
②上述步骤①②③分离操作分别为过滤、_________、_________。
(3)从海水提取的粗盐中含有Mg2+、Fe2+、Ca2+和SO42—等杂质,“除杂”所需试剂有:①过量的NaOH溶液②过量的Na2CO3溶液③适量的盐酸④过量的BaCl2溶液.试剂的添加顺序为_________。
为使Ca2+完全沉淀,溶液中c(CO32—)应不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,离子浓度小于1×10-5mol/L视为完全沉淀]
(4)目前,利用食盐制取纯碱主要有“氨碱法”和“联合制碱法”两种工艺

①能析出 NaHCO3的原因是_________。
②“氨碱法”是在滤液中加入_________产生NH3,循环使用,但产生大量的度弃物CaCl2;“联合制碱法“是在滤液中继续通入NH3,并加入NaCl粉末以制得更多的副产物_________。
③常温下,向饱和食盐水中通入NH3和CO2,当(HCO3—)=c(NH4+)时,溶液的pH_____7 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
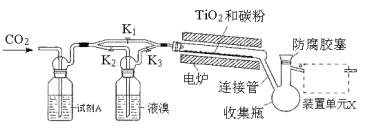
(1)检查装置气密性并加入药品后,加热前应进行的操作是___,反应结束后应继续通入一段时间CO2,主要目的是___。
(2)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为___、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
II.过氧化钙溶于酸,极微溶于水,不溶于乙醇、乙醚和丙酮,通常可用作医用杀菌剂、消毒剂、防腐剂。已知从溶液中制得的过氧化钙带有8个结晶水,在100℃时会脱水生成米黄色的无水过氧化钙,而无水过氧化钙在349℃时会迅速分解生成CaO和O2。以下是一种用纯净的碳酸钙制备过氧化钙的实验方案。请回答下列问题:
CaCO3![]() 滤液
滤液![]()
![]() 白色结晶
白色结晶
(3)步骤①的具体操作为向碳酸钙中逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈___性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是__。
(4)步骤②中反应的化学方程式为__,该反应需要在冰浴下进行,原因是__。
(5)为测定产品中过氧化钙的质量分数,取1.2g样品,在温度高于349℃时使之充分分解,并将产生的气体(恢复至标准状况)通过如图所示装置收集,测得量筒中水的体积为112mL,则产品中过氧化钙的质量分数为___。
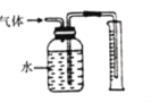
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com