
| A. | 元素周期表中前三周期为短周期 | |
| B. | 第IA族的元素不全是金属元素 | |
| C. | 元素性质呈现周期性变化的根本原因是元素的相对原子质量呈周期性变化 | |
| D. | 人类可以在周期表中金属与非金属的分界线处,寻找半导材料 |
分析 A.周期表中1、2、3周期为短周期元素;
B.第ⅠA族元素中,H属于非金属元素;
C.元素性质呈现周期性变化的根本原因是元素的原子序数呈周期性变化;
D.据金属和非金属的分界线元素的性质分析.
解答 解:A.在元素周期表中,前三周期元素属于短周期元素,故A正确;
B.第IA族的元素不全是金属元素,如H元素为非金属元素,故B正确;
C.元素周期律的内容为:元素性质呈现周期性变化的根本原因是元素的原子序数呈周期性变化,不是随相对原子质量呈周期性变化,故C错误;
D.在元素周期表的金属与非金属的分界线附近的元素的金属性和非金属性都较弱,常用于半导体材料,故D正确;
故选C.
点评 本题考查了元素周期律与元素周期表的综合应用,题目难度中等,注意熟练掌握元素周期表结构、元素周期律内容,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯、1,3-丁二烯、聚乙烯均能与溴水发生加成反应 | |
| B. | 实验室中要除去乙烷中混有的乙烯气体,可以用通入H2催化加氢的方法 | |
| C. | 沸点由高到低依次为:正戊烷>异戊烷>新戊烷>正丁烷>异丁烷 | |
| D. | 室温光照条件下,可以用CH4与氯气制取纯净的一氯甲烷,该反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有机物的结构简式如图:则此有机物可发生的反应类型有( )
有机物的结构简式如图:则此有机物可发生的反应类型有( )| A. | ①②③⑤⑥⑧ | B. | ②③④⑤⑥ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的元素符号为O | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 它的氢化物的电子式为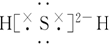 | |
| D. | 其电子排布图为 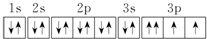 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
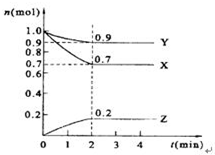 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 180Hf转化为185Hf是化学变化 | |
| B. | 二者的核外电子数分别为108、113 | |
| C. | 1mol 180Hf的中子数比1mol 185Hf少5NA | |
| D. | 在元素周期表中的位置不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中生成1 mol Cl2,转移电子2 mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com