
 甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
分析 (1)探究温度对化学反应速率的影响,应选择浓度相同条件下的实验;
(2)Na2S2O3和H2SO4反应会产生黄色浑浊(S单质生成),同时生成硫酸钠、水和二氧化硫气体,Na2S2O3中硫元素的化合价既升高,又降低,根据得失电子守恒写出反应方程式;
(3)碘离子具有还原性,+6铬具有氧化性,两者发生氧化还原反应,该反应中Cr元素化合价由+6价变为+3价、I元素化合价由-1价变为0价,根据得失电子守恒、电荷守恒写出离子方程式;
(4)碘遇淀粉试液变蓝色;
(5)根据硫代硫酸钠的物质的量计算碘的物质的量,根据碘和钡离子之间的关系计算钡离子物质的量浓度.
解答 解:(1)探究温度对化学反应速率的影响,应选择浓度相同条件下的实验,①和④的温度不同,浓度相同,所以选①④,
故答案为:①④;
(2)Na2S2O3和H2SO4反应会产生黄色浑浊(S单质生成),同时生成硫酸钠、水和二氧化硫气体,Na2S2O3中硫元素的化合价既升高,又降低,方程式为:
Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,
故答案为:①④;Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O;
(3)BaCrO4沉淀中+6铬具有氧化性,HI混合溶液中-1价的碘离子具有还原性,两者发生氧化还原反应,生成+3价铬和单质碘,
反应为:2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O,
故答案为:2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O;
(4)碘遇淀粉试液变蓝色,滴入最后一滴溶液,锥形瓶内溶液有蓝色变为无色,且30s内不复原,
故答案为:滴入最后一滴溶液,锥形瓶内溶液有蓝色变为无色,且30s内不复原;
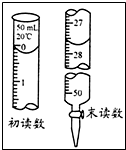
(5)根据2S2O32-+I2=S4O62-+2I-得n(I2)=$\frac{1}{2}$n(S2O32-)=$\frac{1}{2}$×[(27.60-0.10)×10-3]L×0.0030mol•L-1,
根据2BaCrO4+6H++16I-═3I2+2Ba2++2Cr3++8H2O得n(Ba2+)=$\frac{2}{3}$ n(I2)=$\frac{2}{3}$×$\frac{1}{2}$×[(27.60-0.10)×10-3]L×0.0030mol•L-1,溶液的体积为25mL=0.025L,所以
c(Ba2+)=$\frac{n(B{a}^{2+})}{V}$=0.0011mol•L-1,
故答案为:0.0011mol/L.
点评 本题考查了氧化还原反应化学方程式、离子方程式的书写、实验条件的选择,氧化还原反应滴定是难点,考查了学生理解能力及灵活应用所学知识的能力,题目综合性较强.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1 可知,金刚石比石墨稳定 | |
| C. | 在101 KPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
目前普遍认为,质子和中子都是由被称为μ夸克和d夸克的两类夸克组成的,μ夸克带电荷量为+2/3e,d夸克带电荷量为-1/3e,e为基元电荷,下列论断可能正确的是
A. 质子由1个μ夸克和1个d夸克组成,中子由1个μ夸克和2个d夸克组成
B. 质子由2个μ夸克和1个d夸克组成,中子由1个μ夸克和2个d夸克组成
C. 质子由1个μ夸克和2个d夸克组成,中子由2个μ夸克和1个d夸克组成
D. 质子由2个μ夸克和1个d夸克组成,中子由1个μ夸克和1个d夸克组成
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
想一想:Ba(OH)2(固态)、CuSO4(固态)、CH3COOH(液态)这些物质为什么归为一类,下列哪个物质还可以和它们归为一类
A.75%的酒精溶液 B.硝酸钠(固态) C.Fe(OH)3 胶体 D.豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
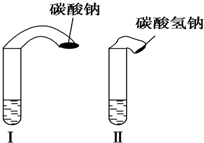 高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:
高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后最高或 最低温度 |
| A | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 24.4℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 用湿润的pH试纸测溶液的pH,测定值一定有误差 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测中和热的值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤①②④③ | B. | ⑤①②④③ | C. | ⑤②①④③ | D. | ④①⑤②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com