
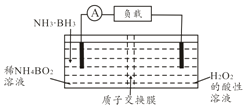
 直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )| A. | 左侧电极发生还原反应 | |
| B. | 电池工作时,H+通过质子交换膜向负极移动 | |
| C. | 正极的电极反应式为2H++2e-=H2↑ | |
| D. | 消耗3.1g氨硼烷,理论上转移0.6mol电子 |
分析 A.反应化学方程式可知过氧化氢为氧化剂得到电子发生还原反应为原电池正极,左侧为原电池负极发生氧化反应;
B.原电池中阳离子移向正极;
C.正极上过氧化氢得到电子发生氧化反应;
D.化学方程式可知消耗1mol氨硼烷的电子转移为6mol.
解答 解:A.原电池装置中分析可知左侧为原电池负极发生氧化反应,右侧为正极发生还原反应,故A错误;
B.电池工作时,H+通过质子交换膜向正极移动,故B错误;
C.正极发生还原反应,根据总反应,电极反应式为H2O2+2H++2e-=2H2O,故C错误;
D.总反应为NH3•BH3+3H2O2═NH4BO2+4H2O,1mol氨硼烷反应电子转移6mol,3.1g氨硼烷的物质的量为=$\frac{3.1g}{31g/mol}$=0.1mol,因此消耗3.1g氨硼烷,理论上转移0.6mol电子,故D正确;
故选D.
点评 本题考查了原电池原理、电解反应书写、离子移向、氧化还原反应电子转移数计算等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.3 mol | C. | 0.6 mol | D. | 1.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| C. | 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量氢氧化钡溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙烷都能发生加聚反应 | |
| B. | 乙烯和苯都能与溴水反应 | |
| C. | 乙醇不能发生取代反应 | |
| D. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中一定含有SO3 |
| B | 向NAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
| C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
| D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中无存在平衡:I3-?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 取少量溶液于试管中,加入KSCN溶液,振荡 | ①颜色无变化 | 不存在Fe3+ |
| 另取少量溶液于试管中,加入②K3[Fe(CN)6]溶液,振荡 | 蓝色沉淀 | 存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2CO(g)=2C(s)+O2(g)△H>0可以自发进行 | |
| B. | 放热反应在常温条件下一定很容易进行 | |
| C. | 平衡常数发生变化,化学平衡一定发生移动 | |
| D. | 化学平衡发生移动,平衡常数一定发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com