
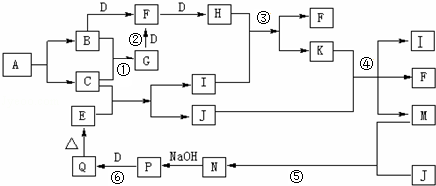
分析 气体单质B、D为空气的主要成分,B能与D连续反应生成H,则B为N2、D为O2、F为NO、H为NO2,反应①、②都是工业生产上的重要反应,气体单质C与氮气反应得到G,G与氧气反应得到NO,则C为H2、G为NH3,化合物A只由两种非金属元素组成,A不稳定,一定条件下爆炸生成B、C,则A为NH4H.E为红棕色氧化物固体,可推得E为Fe2O3,H2还原Fe2O3得H2O和Fe,J为固体单质,则J为Fe、I为H2O,可推知K为HNO3,④反应中K过量,则M为Fe(NO3)3,N为Fe(NO3)2,P为Fe(OH)2,Q为Fe(OH)3,据此解答.
解答 解:气体单质B、D为空气的主要成分,B能与D连续反应生成H,则B为N2、D为O2、F为NO、H为NO2,反应①、②都是工业生产上的重要反应,气体单质C与氮气反应得到G,G与氧气反应得到NO,则C为H2、G为NH3,化合物A只由两种非金属元素组成,A不稳定,一定条件下爆炸生成B、C,则A为NH4H.E为红棕色氧化物固体,可推得E为Fe2O3,H2还原Fe2O3得H2O和Fe,J为固体单质,则J为Fe、I为H2O,可推知K为HNO3,④反应中K过量,则M为Fe(NO3)3,N为Fe(NO3)2,P为Fe(OH)2,Q为Fe(OH)3.
(1)反应②是氨的催化氧化,化学反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)NH3的水溶液呈碱性的原因是:NH3+H2O?NH3•H2O?NH4++OH-,
故答案为:NH3+H2O?NH3•H2O?NH4++OH-;
(3)标况下,将集满NO2气体的试管倒扣于水槽中,发生反应:3NO2+H2O=2HNO3+NO,3体积NO2反应生成1体积NO,溶液体积等于NO2体积的$\frac{2}{3}$,设NO2为3mol,则生成HNO3为2mol,溶液物质的量浓度为$\frac{2mol}{\frac{2}{3}×3mol×22.4L/mol}$=0.045mol/L,
故答案为:0.045mol/L;
(4)P→Q是氢氧化亚铁转化为氢氧化铁,反应过程中会观察到的实验现象为:白色沉淀迅速变成灰绿色,最终变为红褐色,
故答案为:白色沉淀迅速变成灰绿色,最终变为红褐色;
(5)如何检验M溶液中铁离子方法为:取少量M溶液于试管中,滴加几滴硫氰化钾溶液,若溶液变红证明含Fe3+,
故答案为:取少量M溶液于试管中,滴加几滴硫氰化钾溶液,若溶液变红证明含Fe3+;
(6)Fe(NO3)3溶液在强碱性环境下可被KClO溶液氧化制得K2FeO4,该反应的离子方程式:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
点评 本题考查无机物推断,涉及氮、铁元素化合物性质与转化,需要学生熟练掌握元素化合物性质,物质状态、颜色、特殊反应等为推断突破口,注意掌握常见化学工业及连续反应,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 由水电离出的c(H+)c(OH-)═10-22的溶液:Fe2+、Na+、NO3-、SO42- | |
| D. | 澄清透明的溶液中SO42-、K+、Cu2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫(俗称硫磺)是一种黄色晶体,质脆.不溶于水,易溶于酒精 | |
| B. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| C. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 | |
| D. | FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | $\frac{5000(2b-a)}{V}$mol/L | B. | $\frac{5(2b-a)}{V}$mol/L | C. | $\frac{(2b-a)}{V}$mol/L | D. | $\frac{1000(2b-a)}{V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 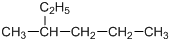 主链上的碳原子数是5 主链上的碳原子数是5 | B. |  名称是3甲基2丁烯 名称是3甲基2丁烯 | ||
| C. | 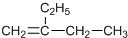 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | D. | 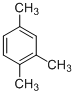 的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和NaOH溶液反应,生成 l mol水时放热57.3 kJ | |
| B. | 含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ | |
| C. | 1L 0.l mol/L CH3COOH与1L 0.l mol/L NaOH溶液反应后放热为5.73 kJ | |
| D. | 1L 0.l mol/L HNO3与 1L 0.l mol/L NaOH溶液反应后放热为 5.73 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.5 mol N2的体积约为33.6 L | |
| B. | NaOH的摩尔质量是40 g | |
| C. | 150mL 1 mol/LNaCl溶液与100mL 1 mol/LAlCl3溶液中的n(Cl-)相等 | |
| D. | 同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com