

| A. | 改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50 mL 0.50 mol/L盐酸和50 mL 0.55 mol/L NaOH进行实验比用 50 mL 0.50 mol/L盐酸和50 mL 0.50 mol/L NaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
分析 A.中和热取决于稀的强酸与强碱反应生成1mol水放出的热量,与酸碱的物质的量无关;
B.碱过量可以保证盐酸完全反应,减小测定误差;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低;
D.中和热测定实验成败的关键是保温工作.
解答 解:A.中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,测得中和热数值相等,故A正确;
B.用50 mL 0.50 mol/L盐酸和50 mL 0.55 mol/L NaOH进行实验比,后者NaOH溶液过量,可保证盐酸完全反应,测得的数值更准确,故B正确;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低,△T偏小,由Q=m•c•△T可知测量结果偏低,故C错误;
D.大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,故D正确;
故选C.
点评 本题考查中和热的测定,题目难度不大,明确中和热测定原理及步骤为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )| A. | 有机电解液可以是乙醇等无水有机物 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 电池正极反应式是O2+4e-=2O2- | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,X的化学式为Fe3C.
,X的化学式为Fe3C.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
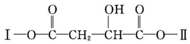 (其中Ⅰ、Ⅱ为未知部分的结构).
(其中Ⅰ、Ⅱ为未知部分的结构).
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 序号 | 步骤 | 现象 |
| I | 向图2装置内充SO2气体 | G中:有气泡冒出,产生白色沉淀;H中:有气泡冒出,产生白色沉淀;液面上方先略显红棕色,后逐渐消失 |
| Ⅱ | 从G、H中过滤出白色沉淀,分别加入稀盐酸中 | G、H中的白色沉淀均不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 14种 | C. | 16种 | D. | 18种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com