
| A、在放电时,电池中硫酸的浓度不断变小 |
| B、在放电时,正极发生的反应是Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| C、在充电时,电池中阴极质量不断变小 |
| D、在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |


科目:高中化学 来源: 题型:
| A、3molC+1molD |
| B、2molA+2molC |
| C、2molA+1molB+0.5molD |
| D、1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:
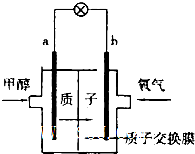 某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同浓度的H2SO4溶液于KOH溶液 |
| B、pH=3的盐酸和pH=11的氨水 |
| C、pH=3的硫酸和pH=11的KOH |
| D、pH=3的醋酸和pH=11的KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-=Cl2↑ |
| B、在碱性介质中,氢氧燃料电池的负极反应式为O2+2H2O+4e-=4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为Cu-2e-=Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式为Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、施用碳铵(NH4HCO3)后应立即盖上土壤 |
| B、复合肥是两种或两种以上化肥的混合物 |
| C、可用工业用盐作食盐用于烹调 |
| D、三聚氰胺(C3N6H6)俗称“蛋白精”,加入到奶粉中,可提高蛋白质的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、c(H+)=c(OH-)=10-6mol/L溶液 |
| C、由强酸、强碱等物质的量反应后得到的溶液 |
| D、滴入甲基橙指示剂显橙色的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、铝粉投入到NaOH溶液中:Al+2OH-═AlO2-+H2↑ |
| C、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com