
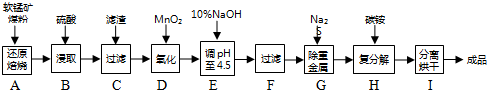
分析 已知:①2CO(g)+O2(g)═2CO2(g)△H═-566KJ/mol,②2H2(g)+O2(g)═2H2O(g)△H═-484KJ/mol,③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-802KJ/mol,根据盖斯定律将热化学方程式③-①-②可得目标反应,据此可计算出目标反应的焓变.
解答 解:已知:①2CO(g)+O2(g)═2CO2(g)△H═-566KJ/mol
②2H2(g)+O2(g)═2H2O(g)△H═-484KJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-802KJ/mol
根据盖斯定律,③-①-②得:CH4(g)+CO2(g)?2CO(g)+2H2 (g)△H=(-802KJ/mol)-(-566KJ/mol)-(-484KJ/mol)=+248KJ/mol,
故答案为:+248KJ/mol.
点评 本题考查了盖斯定律在热化学方程式中的计算,题目难度中等,明确盖斯定律的内容及含义为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出218 kJ | B. | 放出109kJ | C. | 吸收218 kJ | D. | 吸收109 kJ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡正向移动 | B. | (a+b)>(c+d) | C. | X的转化率变大 | D. | Z的体积分数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 同系物的化学性质相似,物理性质随碳原子数的递增呈现规律性变化 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
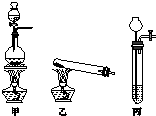 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com