
| A. | 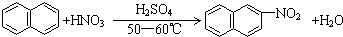 | |
| B. | CH3CH2CH2CHOHCH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O | |
| D. | CH3COOH+CH3OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH3+H2O |
分析 有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,结合官能团的变化解答该题.
解答 解:A. ,苯环上的氢原子被硝基所取代,属于取代反应,故A不选;
,苯环上的氢原子被硝基所取代,属于取代反应,故A不选;
B.CH3CH2CH2CHOHCH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O,醇分子内脱水,生成碳碳双键,属于消去反应,故B选;
C.2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O,乙醇分子间脱水,属于取代反应,故C不选;
D.CH3COOH+CH3OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH3+H2O是乙酸与乙醇发生的酯化反应,属于取代反应,故D不选.
故选B.
点评 本题考查有机物的性质、有机反应类型,题目较为简单,注意理解常见有机反应类型,注意取代反应与其它反应类型的区别.


科目:高中化学 来源: 题型:解答题
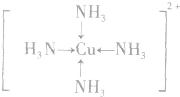 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的成分为次氯酸钙,是纯净物 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 干燥Cl2可使干燥有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
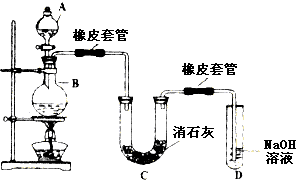
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇中的水(CaO、蒸馏) | B. | 溴乙烷中的乙醇(水、分液) | ||
| C. | 苯中的甲苯(Br2水、分液) | D. | 溴苯中的溴(NaOH溶液、分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 全部 | C. | ②④⑤⑦ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com