

| A. | 用润湿的pH试纸测定0.1mol/L氨水的pH值 | |
| B. | 在CaCO3饱和溶液中,加入Na2CO3固体,平衡时c(Ca2+)=c(CO${\;}_{3}^{2-}$)=$\sqrt{{K}_{sp}CaC{O}_{3}}$ | |
| C. | 图I装置可用于探究浓度对化学反应速率的影响 | |
| D. | 观察图II导管中水柱的变化,可知该条件下铁钉主要发生了析氢腐蚀 |
分析 A.润湿的pH试纸,测定氨水的pH偏小;
B.加入Na2CO3固体,使碳酸钙的溶解平衡逆向移动;
C.固定相同形状、大小的Zn,适当改变硫酸的浓度,观察针筒中出现相同体积的气体时快慢;
D.食盐水为中性,发生吸氧腐蚀.
解答 解:A.润湿的pH试纸,测定氨水的pH偏小,则试纸不能润湿,故A错误;
B.加入Na2CO3固体,使碳酸钙的溶解平衡逆向移动,c(Ca2+)<c(CO32-),但Ksp不变,故B错误;
C.固定相同形状、大小的Zn,适当改变硫酸的浓度,观察针筒中出现相同体积的气体时快慢,则图I装置可用于探究浓度对化学反应速率的影响,故C正确;
D.食盐水为中性,观察图II导管中水柱的变化可知发生吸氧腐蚀,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及pH的测定、反应速率及平衡移动、原电池等,把握实验操作、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次升高 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 2-甲基-1,3-丁二烯的键线式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
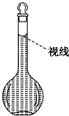 实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2═Ba2++2OH- | B. | H2SO4═2H++SO42- | ||
| C. | NaHCO3═Na++H++CO3- | D. | NaCl═Na++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10 mL量筒量取8.58 mL蒸馏水 | |
| C. | 用强光照射鉴别淀粉胶体与碳酸钠两种无色液体 | |
| D. | 蒸馏时,应将温度计的水银球插入液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com