
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的一种常见溶剂的化学式为________,其立体构型为________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为________;该元素与元素①形成的最简单分子X属于________分子(填“极性”或“非极性”)。
(4)元素④的第一电离能________元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为________。
(6)元素⑩的基态原子核外电子排布式是________。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________________________________________________________
________________________________________________________________________。
科目:高中化学 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O15、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O15 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
该工艺的主要流程如下。
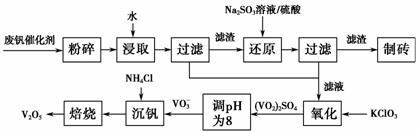
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式
________________________________________________________________________。
(2)催化氧化所使用的催化剂钒触媒(V2O15)能加快二氧化硫的氧化速率,此过程中产生了一连串的中间体(如图1)。其中a、c两步的化学方程式可表示为________________________,________________________________。
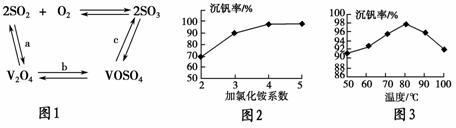
(3)该工艺中沉钒率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵的系数(NH4Cl加入质量与料液中V2O15的质量比)和温度。根据图2和图3,试建议控制氯化铵系数和温度的适宜值分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________(用字母表示,下同)。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是__________。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为____________,反应所需时间的长短关系是__________。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________________________________________________________________________。
(7)将c(H+)相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O??HCl+HClO达到平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体 B.水
C.CaCO3固体 D.NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:
①1s22s2 2p63s23p4;②1s22s22p63s23p3;
③1s22s2 2p3;④1s22s22p5。
则下列有关比较中正确的是 ( )。
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下图的实验装置用来分离CO2和CO气体并干燥。图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹分别接c、d两球胆,现装置内的空气已排尽。为使实验成功,甲、乙、丙中盛放的溶液分别是( )。

A.NaHCO3饱和溶液、12 mol·L-1盐酸、18.4 mol·L-1硫酸
B.Na2CO3饱和溶液、2 mol·L-1硫酸、NaOH饱和溶液
C.NaOH饱和溶液、2 mol·L-1硫酸、18.4 mol·L-1硫酸
D.18.4 mol·L-1硫酸、NaOH饱和溶液、18.4 mol·L-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质。过程如下:
提出问题:
①在周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性也小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
实验方案:
(1)解决问题①需用到的药品有CuSO4溶液、________(填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80~100℃时,得到 80 g黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为________。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为___________________。
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为
__________________________________________________。
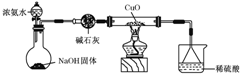
实验结论:
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是_____________________。
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:高温时________;在酸性溶液中________。
(6)CuO能被NH3还原。
问题讨论:
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于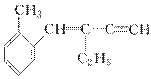 下列结论正确的是 ( )。
下列结论正确的是 ( )。
A.该有机物分子式为C13H16
B.该有机物属于苯的同系物
C.该有机物分子至少有4个碳原子共直线
D.该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,振荡后溶液变蓝,再加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断错误的是( )
A.氧化性:ClO->SO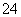 >I2
>I2
B.漂粉精溶液可使淀粉碘化钾试纸变蓝
C.ClO-与I-在碱性条件下可以发生氧化还原反应
D.向新制氯水中加入足量亚硫酸钠溶液,氯水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com