
����Ŀ��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ���������ȣ���仯�ɱ���Ϊ��2KClO3+4HCl��Ũ���T2KCl+2ClO2��+Cl2��+2H2O�� a��������÷�Ӧ�е���ת�Ƶ������˫���ŷ���ʾ���� ��
b�����������뻹ԭ��������ʵ���֮��Ϊ
c��Ũ�����ڷ�Ӧ����ʾ������������ �� ����д��ţ�
��ֻ�л�ԭ�ԣ��ڻ�ԭ�Ժ����ԣ���ֻ�������ԣ��������Ժ����ԣ�
d������0.1mol Cl2 �� ��ת�Ƶĵ��ӵ����ʵ���Ϊmol��
���𰸡�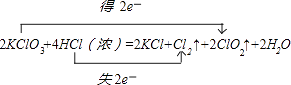 ��1��2���ڣ�0.2
��1��2���ڣ�0.2
���������⣺a��KClO3��ClԪ�صĻ��ϼ۴�+5�۽��͵�0�ۣ���5�����ӣ�HClʧȥ5�����ӣ������ת�Ƶķ������ĿΪ 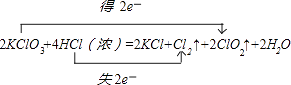 �ʴ�Ϊ��
�ʴ�Ϊ�� 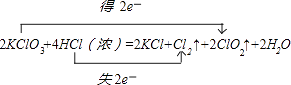 ��
��
b����Ӧ��KClO3Ϊ�����������Ի�ԭ����Ϊ�������ȣ�HClΪ��ԭ������������Ϊ���������������뻹ԭ��������ʵ���֮��Ϊ1��2��
�ʴ�Ϊ��1��2��
c����Ӧ2KClO3+4HCl��Ũ��=2KCl+Cl2��+2ClO2��+2H2O�У�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������HCl�ڷ�Ӧ�л�ԭ����������ã�����һ�룮
��ѡ���ڣ�
d����Ӧ��ֻ��Cl2���������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����Բ���0.1molCl2 �� ת�Ƶĵ��ӵ����ʵ���Ϊ0.1mol��2=0.2mol��
�ʴ�Ϊ��0.2mol��
a��KClO3��ClԪ�صĻ��ϼ۴�+5�۽��͵�0�ۣ���5�����ӣ�HClʧȥ5�����ӣ�
b����Ӧ��KClO3Ϊ�����������Ի�ԭ����Ϊ�������ȣ�HClΪ��ԭ������������Ϊ������
c����Ӧ2KClO3+4HCl��Ũ��=2KCl+Cl2��+2ClO2��+2H2O�У�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������HCl�ڷ�Ӧ�л�ԭ����������ã�����һ�룻
d����Ӧ��ֻ��Cl2���������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ��ݴ˼���ת�Ƶ������ʵ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���֬��˵����ȷ����( )
A. ��֬�Ǵ����� B. ��֬�Ǹ߷��ӻ�����
C. ��֬�ǻ���� D. ֲ���Ͳ���ʹ���������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���ӻ�������ֻ�ܺ����Ӽ��������й��ۼ�
B. ����״̬���ܵ��������һ�������ӻ�����
C. ��������ͬ��������һ����ͬһԪ��
D. ��ȫ�ɷǽ���Ԫ���γɵĻ������п��ܺ������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����Թܷ���ʢ��25��ʱ����ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���2mL�������Թ��С����ж��ձ��е�ʵ�������������ԭ��˵������ȷ����()
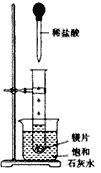
A. �ձ��г��ְ�ɫ���ǣ�ԭ�����Թ��еķ�Ӧ�ų�����ʹ�ձ��б���ʯ��ˮ�¶����ߣ���������
B. �ձ��г��ְ�ɫ���ǣ�ԭ�����Թ��еķ�Ӧ��������ʹ�ձ��б���ʯ��ˮ�¶Ƚ��ͣ���������
C. �ձ���û���κ�����ԭ�����Թ��еķ�Ӧ���ձ��б���ʯ��ˮû�й�ϵ
D. �ձ���û���κ�����ԭ�����Թ��еķ�Ӧ�Ȳ��ų�������Ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������KMnO4��Һ���ܴﵽԤ��Ŀ�ĵ���
A.����SO2��CO2B.����CH2=C(CH3)CHO�к�̼̼˫��
C.���𱽺ͼױ�D.������������Һ���Ƿ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ�ԭ���������弰���ȡ���������ҹ���18�У�������˵���д�����ǣ�������
A. ��17��Ϊ±��Ԫ��
B. ��9��Ԫ����û�зǽ���Ԫ��
C. ֻ�е�2��Ԫ��ԭ�ӵ��������2������
D. ������18��Ԫ���У���3��Ԫ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӱȶ������κ��˶�ʧ���������õ�����Ч������ṹ��ͼ��ʾ���й����ӱȵ�˵����ȷ���ǣ� ��
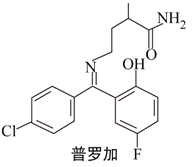
A. �����ڿ����в��ױ���
B. һ�������£�1mol���ӱ��������2molH2�����ӳɷ�Ӧ
C. �÷����ں˴Ź�����������12����
D. ���ӱȿ��Ժ�NaOH��Һ��Na2CO3��Һ��Ӧ��Ҳ���Ժ����ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����˵��M�ķǽ�����ǿ��N���ǣ�������
A. �������������ϵ����׳̶ȣ�M����N
B. ����������Ӧˮ��������ԣ�M����N
C. �������ӵĻ�ԭ�ԣ�Mǿ��N
D. N�ĵ����ܴӺ�M�ļ������ӵ���Һ���û���M����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����M��R��������Ԫ�أ���֪M2����R�����������֮��Ϊ20��������˵������ȷ����(����)
A. M��R��������֮��һ������19 B. M��R���ֱܷ��ڵڶ����ں͵�������
C. M��R���ֱܷ��ڵ�������͵�һ���� D. M��R��������֮����ܵ���7
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com