
下列排列顺序不正确的是()
A. 原子半径:Na>S>O B. 酸性:H3PO4>H2SO4>HClO4
C. 热稳定性:HF>HCl>HBr D. 元素金属性:Na>Mg>Al
考点: 微粒半径大小的比较;金属在元素周期表中的位置及其性质递变的规律;非金属在元素周期表中的位置及其性质递变的规律.
专题: 元素周期律与元素周期表专题.
分析: A.电子层越多半径越大,电子层相同时原子序数越大半径越小;
B.元素的非金属性越强,对应的最高价氧化物的水化物越强;
C.元素的非金属性越强,对应的氢化物越稳定;
D.同周期元素从左到右元素的金属性逐渐减弱.
解答: 解:A.电子层越多半径越大,则O原子半径最小,电子层相同时原子序数越大半径越小,则Na>S,故A正确;
B.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物越强,故B错误;
C.非金属性F>Cl>Br,元素的非金属性越强,对应的氢化物越稳定,故C正确;
D.同周期元素从左到右元素的金属性逐渐减弱,则元素金属性:Na>Mg>Al,故D正确.
故选B.
点评: 本题考查元素周期律的递变规律,题目难度中等,注意元素的金属性、非金属性与元素对应的单质、化合物的性质关系.


科目:高中化学 来源: 题型:
在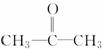 分子中,羰基碳原子与甲基碳原子成键时所采取的杂化方式分别为 ( )。
分子中,羰基碳原子与甲基碳原子成键时所采取的杂化方式分别为 ( )。
A. sp2杂化;sp2杂化 B.sp3杂化;sp3杂化
C.sp2杂化;sp3杂化 D.sp杂化;sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
A.制汽轮机 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)写出N的原子结构示意图__________,根据元素周期律知识,请写出氮化硅的化学式_______________________________________________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________________________________。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
表明金属甲比金属乙活动性强的叙述正确的是()
A. 在氧化还原反应中,甲失的电子比乙多
B. 同价态阳离子,甲比乙氧化性强
C. 将甲和乙用导线相连接,一同放入CuSO4溶液中,乙的表面有红色的铜析出
D. 将甲、乙组成原电池时,甲为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施对增大反应速率明显有效的是()
A. Na与水反应时增大水的用量
B. Fe与稀硫酸反应制取氢气时,改用浓硫酸
C. 将锌与稀硫酸反应时,向溶液中加入少量CuSO4 晶体
D. 用碳还原Fe2O3冶炼铁时,增大碳的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(g)+5B(g)⇌4C(g)+6D(g) 在5L的密闭容器中进行反应,30min后,C的物质的量增加了0.30mol.下列叙述正确的是()
A. 30min中A的平均反应速率是0.010mol•L﹣1•min﹣1
B. 容器中D的物质的量一定增加了0.45mol
C. 容器中A、B、C、D的物质的量的比一定是4:5:4:6
D. 容器中A的物质的量一定增加0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是( )
|
| A. | HCO3﹣+H2O⇌H3O++CO32﹣ | B. | HCO3﹣+H2O⇌H2CO3+OH﹣ |
|
| C. | CO2+H2O⇌HCO3﹣+H+ | D. | CH3COOH⇌CH3COO﹣+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、X存在如图甲所示转换关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.X可能是强酸,也可能是强碱.
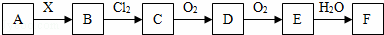
(1)A的化学式是 .
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为 .
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物.
①过量的B跟Cl2反应的化学方程式为 .
②工业生产中B→D的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com