
科目:高中化学 来源: 题型:阅读理解
| X |
| X |
| H2O |
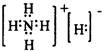
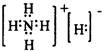
查看答案和解析>>
科目:高中化学 来源:2012届辽宁省葫芦岛一高高二下学期第二次月考化学试卷 题型:填空题
(12分)
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:

(1)下列由极性键形成的非极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的 。

A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体[来源:学*科*网]
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为: 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸、烧碱、氯化钠和氧化铝分别属于酸、碱、盐和氧化物 |
| B.蔗糖、硫酸钡和氨水分别属于非电解质、强电解质和弱电解质 |
| C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 |
| D.能用同一通式表示的几种物质一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F六种元素的原子序数依次递增, A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满。
请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)C的基态原子的外围电子排布式为 ,周期表中F
属于 区。
(2)C、D、E三元素的电负性由大到小的顺序为: ,简单离子半径由大到小的顺序为: 。
(3)BD分子中,B原子与D原子都达到8电子稳定结构,则BD的电子式是 ;
(4)BD2与EDA反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是: 。
 (5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(6)右图分别是E和F的晶胞。晶体中E和F的配位数之比为 。
(7)相同条件下,V1mLBD2与V2mLCD的混合气体通过足量E2D2固体后,气体体积变为(V1+V2)/2mL(不考虑CD与E2D2的反应),则V1与V2的关系满足: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com