
 在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol
在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol分析 N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,依据热化学方程式书写得到;
(1)根据盖斯定律来计算化学反应的焓变,结合焓变和系数之间的关系来回答;
(2)根据盖斯定律来计算化学反应的焓变,书写热化学方程式即可;
(3)N4气体转变为N2气体先破坏N4分子N-N键吸收能量,再生成N2分子形成N≡N键放出能量,注意一个N4分子中含有6个N-N键,根据能量的变化写出热化学反应方程式;
(4)电池放电时是原电池,将化学能转化为电能,负极发生氧化反应,电极反应式为:CH4+10 OH--8e-=CO32-+7H2O;
(5)根据容器中还剩余c molN2计算出消耗的N2的物质的量,再计算出N2的转化率;利用三段式法计算平衡时H2的平衡浓度.
解答 解:N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,反应的热化学方程式为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol;
故答案为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol;
(1)①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220.0kJ•mol-1
②H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则丙烷燃烧生成CO2和气态水时的反应为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g),△H=①+②×4=-2220.0kJ•mol-1+4×44.0kJ•mol-1=2044kJ•mol-1,所以
0.5mol丙烷燃烧生成CO2和气态水时释放的热量为1022kJ,故答案为:1022kJ;
(2)①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
(3)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收193kJ/mol×6mol=1158KJ能量;
生成2molN≡N键放出941kJ/mol×2mol=1882KJ能量,所以该反应放出1884KJ-1158KJ=724KJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=-724KJ/mol,
故答案为:724;
(4)电池放电时是原电池,将化学能转化为电能,负极发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故答案为:化学;电;CH4+10OH--8e-=CO32-+7H2O;
(5)根据反应方程式N2+3H2 ?2NH3
开始 a b 0
转化 a-c 3(a-c) 2(a-c)
平衡 c b-3(a-c) 2(a-c)
则平衡时N2的转化率=$\frac{a-c}{a}$×100%;
H2的转化率=$\frac{3(a-c)}{b}$×100%;容器中H2的平衡浓度=$\frac{b-3(a-c)}{1}$=(b-3a+3c)mol/L
故答案为:$\frac{a-c}{a}$×100%;$\frac{3(a-c)}{b}$×100%;(b-3a+3c)mol/L.
点评 本题考查了盖斯定律及原电池原理,难点是电极反应式的书写,要根据电解质溶液的酸碱性书写,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子带电荷并且在一定条件下能稳定存在Ba2+,Cu2+,Ag+溶液沉淀1溶液沉淀3+C+B+A沉淀2 | |
| B. | 胶体的分散质粒子直径在1 nm~100nm之间 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
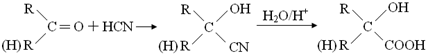
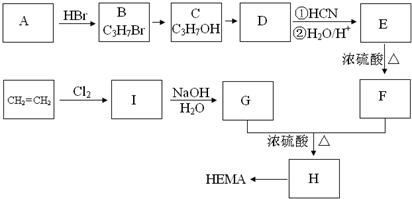
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
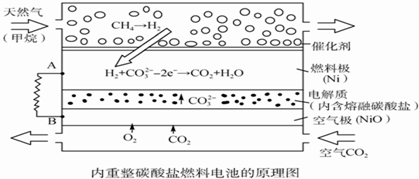
| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可使湿的红布条褪色,所以氯气具有漂白性 | |
| B. | 氯气没有漂白性,但通入品红溶液中,品红褪色 | |
| C. | 氯气不跟非金属反应 | |
| D. | 氯气有毒,闻其气味时要小心将集气瓶放在鼻孔下直接闻其气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、明矾净水原理相同 | |
| B. | 过氧化钠、活性炭均可用于呼吸面具 | |
| C. | 硅胶和铁粉均可用于食品的防氧化 | |
| D. | 甲烷的氯代物均可作防火材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com