
【题目】某蛋白质有n个氨基酸,若由m条肽链组成,则该蛋白质至少有多少个氧原子( )
A. n-m B. n+m C. n+2m D. n-2m
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2 C(s)+O2(g)═CO2(g)△H3
则反应4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H的表达式为_____
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

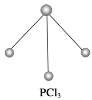
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH=_____。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:


(1)制备粗品将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是_______。
②试管C置于冰水浴中的目的是___________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填上或下),分液后用___________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入,目的是_____________。
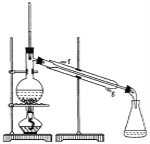
③收集产品时,控制的温度应在__________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(______)
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用酸性高锰酸钾溶液 b.用溴水溶液 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α射线是由α粒子组成,α粒子是一种没有核外电子的粒子,它带有2个单位的正电荷,它的质量数等于4,由此可推断α粒子含有____个质子,______个中子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
A. 固体A的质量B. 混合气体的密度
C. 混合气体的平均相对分子质量D. 混合气体的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验:
(1)若要比较镁、铝的金属性强弱,下列方案可行的是:____________(填序号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将等量的这两种元素的单质粉末分别与同浓度的盐酸反应
c.将这两种元素的单质粉末分别与热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:______________________________________________。
(3)利用如图装置(夹持装置省略)可以验证部分元素的非金属性强弱。
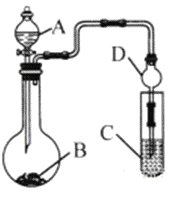
①实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫,烧瓶中发生反应的化学方程式为:_____________________________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为:_____________________________。
②若要自选药品证明非金属性:C>Si,则A中加__________、B中加Na2CO3粉末、C中加_____________,观察到C中溶液的现象为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
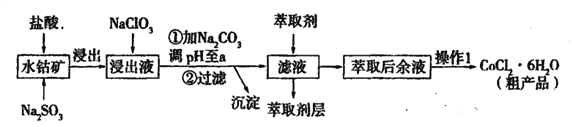
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O![]() CH3COO+2H++2Ag↓+3NH3↑+
CH3COO+2H++2Ag↓+3NH3↑+![]()
B. 苯酚钠溶液中通入少量CO2:![]() +H2O+CO2
+H2O+CO2![]()
![]() +
+![]()
C. 硫酸氢铵溶液中滴加少量NaOH溶液:H++![]() +2OH
+2OH![]() NH3·H2O+H2O
NH3·H2O+H2O
D. 氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH![]() CH2ClCOO+H2O
CH2ClCOO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A. CH2=CHCOOH和油酸 B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
(1)互为同位素的是________;
(2)互为同系物的是________;
(3)互为同素异形体的是________;
(4)互为同分异构体的是________;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com