
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C+和B3-具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的原子个数为1:1的化合物,是人们生活的必需品。回答下列问题:
(1)五种元素中,原子半径最大的是______,非金属性最强的是______(填元素符号)。
(2)由A和D、E所形成的共价型化合物中,热稳定性差的是________(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,所得产物中存在的化学键类型为_______。用电子式表示A和B其形成化合物过程________________________________________。
(4)D最高价氧化物的水化物的化学式为____________。
(5)将单质E通入氯化亚铁溶液时,反应的离子方程式为________________。
【答案】(1)Na;Cl (2)PH3(3)离子键和共价键![]()
(4)H3PO4(或 HPO3) (5)2Fe2++Cl2==2Fe3++2Cl-
【解析】试题分析:五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C+和B3-具有相同的电子层结构,则C为Na、B为N元素,D为P元素;A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,则A为H元素;C和E形成的原子个数为1:1的化合物,是人们生活的必需品,则E是Cl元素。
(1)同周期自左向右原子半径逐渐减小,元素非金属性随着原子序数增大而增强,同一主族元素,自上而下原子半径逐渐增大,元素非金属性随着原子序数增大而减弱,这几种元素中非金属性最强的是Cl元素,原子半径最多的是Na;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性P<Cl,所以氢化物的热稳定性较差的是PH3;
(3)A和E形成的化合物是氯化氢,A和B形成的化合物是氨气,二者反应生成氯化铵,其化学式为NH4Cl;铵根离子和酸根离子之间存在离子键、N-H原子之间存在共价键;氨气是含有共价键的共价化合物,其形成过程可表示为![]() 。
。
(4)D为P元素,其最高价氧化物的水化物是磷酸,化学式为H3PO4;
(5)E的单质是氯气,为黄绿色气体,氯气具有强氧化性,能氧化亚铁离子生成铁离子而导致溶液变为黄色,离子方程式为2Fe2++Cl2==2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】2丁烯(CH3—CH = CH—CH3)是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2丁烯与氢气反应生成正丁烷,正丁烷的结构简式为 ,正丁烷的同分异构体的系统命名为_____________。
(2)写出2丁烯与溴的四氯化碳溶液反应的化学方程式:_______________,
写出在一定条件下合成聚2丁烯的化学方程式 。
(3)2-丁烯存在着顺、反异构现象,写出反-2-丁烯的结构简式 。
(4)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,烯烃A分子中共平面的原子最多有________个。
(5)研究表明烯烃可发生复分解反应。烯烃的复分解反应指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如两分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR'。写出在催化剂作用下,(4)中的两个烯烃A分子发生复分解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ、用下列:①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤Cl2 ⑥ Ar ⑦CO2 等物质填空。 (1—4小题填序号)
(1) 由离子键和非极性键构成的是
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是
(4) 共价化合物有
(5) 写出下列物质的电子式:Na2O2
Ⅱ、某元素原子的价电子构型为4s24p1,它属于第________周期________族,属________区元素
Ⅲ、Cu3N的晶胞结构如图,N3-的配位数为 ,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为 g·cm-3。(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14)
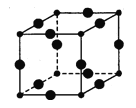
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu(NH3)4]SO4·H2O。
(1)Cu基态核外电子排布式为 。
[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中碳原子轨道杂化类型为 。
与H2O互为等电子体的一种阴离子为 (填化学式)。
(3)[Cu(NH3)4]SO4·H2O含有 。(填序号)
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.氢键
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是 。
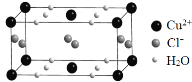
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物。右图为苯氧乙酸的结构简式。
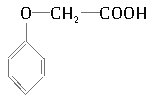
(1)甲一定含有的官能团的名称是___________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不
含甲基,且为链状结构,其结构简式是______________(碳碳双键上连有羟基的结构不稳定)
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有两种一硝基取代物的同分异构体是(写出任意两种的结构简式)____________________ ________________
(4)已知:
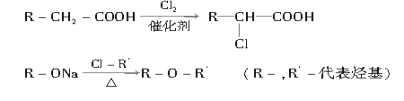
菠萝酯的合成路线如下:
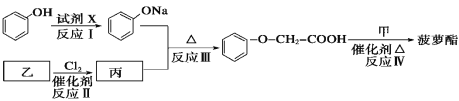
①试剂X不可选用的是(选填字母)________。
a. Na2CO3溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是__________________,反应Ⅱ的反应类型是____________。
③反应Ⅳ的化学方程式是_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化属于放热反应的是______________(填序号)。
①葡萄糖在人体内被氧化成CO2;②天然气的燃烧;③煅烧大理石;④稀盐酸与稀氨水混合;⑤生石灰与水反应生成熟石灰;⑥干冰的升华;⑦钠与水反应;⑧消石灰与氯化铵晶体的反应
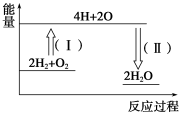
(2)氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,请回答下列问题:
①若2 mol氢气完全燃烧生成水蒸气,则放出的热量______(填“大于”、“小于”或“等于”)572 kJ。
②反应2H2+O2==2H2O的能量变化如图所示。已知拆开1 mol H2、1 mol O2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ能量,则反应过程(Ⅱ)___(填“吸收”或“放出”)___kJ能量。
(3)已知反应2HI(g)==H2(g)+I2(g) ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】硼与铝为同族元素。据报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录,硼、镁及其化合物在工农业生产中应用广泛;硼酸(H3BO3)是极弱的一元弱酸。硼镁矿主要成分为Mg2B2O5.H2O,用硼镁矿、碳铵法实验室制备硼酸的主要流程如下:
![]()
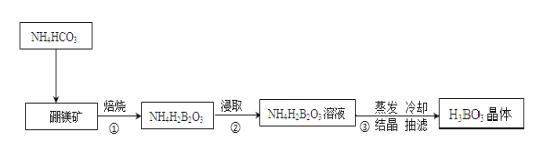
请回答:
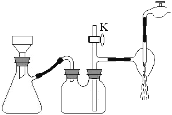
(1)步骤①中实验室需要把硼镁矿放在 仪器中焙烧(填实验仪器)。
(2)步骤③中采用减压过滤,该小组同学所用的装置如右图所示,若实验过程中发现倒吸现象,应采取最简单的实验操作是 ;从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷却结晶、抽滤、洗涤、干燥获得硼酸晶体,下列实验条件容易使得到的硼酸晶体有较大颗粒的是 。
A.较高温度下快速蒸发
B.用冰水冷却 NH4H2BO3溶液
C.采用较稀的NH4H2BO3溶液
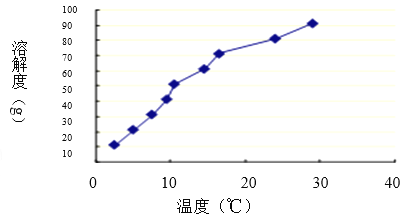
(3)硼酸是极弱的一元弱酸,用离子方程式表示硼酸溶液显酸性的原因 ;硼酸溶解度如下图所示,从操作③中获得H3BO3晶体需要洗涤、干燥,洗涤过程中需要用 (填“冷水”或“热水”),你的理由是 ;
(4)测定硼酸晶体纯度的试验方法是,取0.5000g样品与锥形瓶中,滴加甘油,微热使样品溶解,迅速冷却至室温,滴加指示剂,用NaOH标准溶液滴定至15.80ml时到达终点。已知:每1.00mlNaOH滴定液相当于30.92mg的H3BO3,则该样品中H3BO3的质量分数为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构】前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同。D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子。
(1)E元素在周期表中的位置是 。
(2)六种元素中电负性最大的元素为 ,前五种元素中第一电离能最小的元素为______(写元素符号)。C元素与元素氟能形成C2F2分子,该分子中C原子的杂化方式是____________。
(3)配合物E(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于 分子(填“极性”或“非极性”)。该分子中σ键与π键数目比为 。
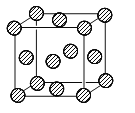
(4)H单质的晶胞结构如图所示,则原子采取的堆积方式为 ,若已知H原子半径为r pm ,NA表示阿伏伽德罗常数,摩尔质量为M,用相应字母表示:
①该原子的配位数为 。
②该晶体的密度为 g/cm3。
③H原子采取这种堆积方式的空间利用率为 (用含π表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如表所示。下列说法中,正确的是
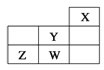
A. W的最高价氧化物对应的水化物是强酸
B. Y的原子半径在同周期主族元素中最大
C. W的非金属性比Z的弱
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com