
| A. | 金属钠属于危化品中的易燃固体,其着火时不能用水灭火 | |
| B. | 氰化钠( NaCN)是一种剧毒危险品,其水溶液呈碱性 | |
| C. | 实验室里可将少量的钠保存于煤油中 | |
| D. | NH4N03、NaCN、CaC2中均含有离子键和非极性共价键 |
分析 A、钠与水反应生成可燃性的气体;
B、氰化物剧毒,NaCN水解呈碱性;
C、钠易与水和氧气反应,所以要隔绝空气保存,钠的密度大于煤油的,且和煤油不反应;
D、NH4N03和NaCN中均含有离子键和极性共价键而CaC2中含有离子键和非极性共价键.
解答 解:A、钠与水反应生成可燃性的气体,所以钠着火时不能用水灭火,故A正确;
B、氰化物剧毒,NaCN是强碱弱酸盐水解呈碱性,故B正确;
C、钠易与水和氧气反应,所以要隔绝空气保存,钠的密度大于煤油的,且和煤油不反应,所以可用煤油保存,故C正确;
D、NH4N03和NaCN中均含有离子键和极性共价键而CaC2中含有离子键和非极性共价键,故D错误;
故选D.
点评 本题考查化学试剂的存放,题目难度不大,注意物质的性质影响保存方法的选择.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
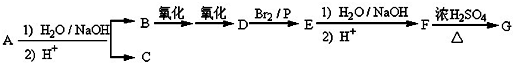

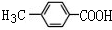 .
.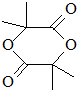 .
.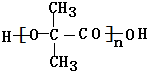 +(n-1)H2O,该反应属于缩聚反应(填反应类型).
+(n-1)H2O,该反应属于缩聚反应(填反应类型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
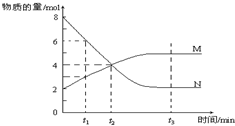
| A. | 该反应的化学方程式为:2 M?N | |
| B. | t1时,V正>V逆 | |
| C. | t2时,V正=V逆,达到平衡 | |
| D. | t 3时,M、N的浓度不再发生变化,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
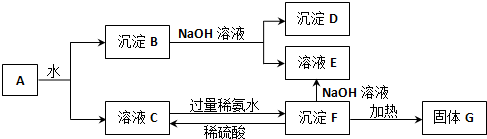
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78克苯中含有碳碳双键的数目为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,2.24LCCl4所含分子数为0.1NA | |
| D. | 0.2mol金属钠与足量的O2反应,产物中离子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W的气态氢化物与M的单质可发生置换反应 | |
| B. | 离子半径的大小顺序为W>M>Z>X>Y | |
| C. | 元素Z、M的单质在一定条件下均能和强碱溶液反应 | |
| D. | 元素X与Y可以形成5种以上的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均满足8电子的稳定结构 | |
| D. | Y、Z均能与碳元素形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
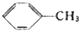 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$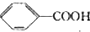
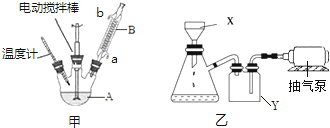
| 名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 112.4(100℃升华) | 248 | 微溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2>HI>H2SO3 | B. | HI>FeCl2>H2SO3 | C. | H2SO3>HI>FeCl2 | D. | FeCl2>H2SO3>HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com