
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.00 | 0.00 | 16.70 | 16.70 | 0.1044 |
| 2 | 16.75 | 0.00 | 17.85 | 17.85 | |
| 3 | 19.55 | 0.00 | 20.80 | 20.80 | 0.1064 |
| 4 | 15.00 | 0.00 | 16.00 | 16.00 | 0.1067 |
分析 (1)根据滴定操作需要的仪器有:滴定管、滴定管夹、铁架台、烧杯外、锥形瓶;
(2)根据强酸与强碱反应溶液呈中性,可选用甲基橙或酚酞作指示剂,当滴定达到终点后,读取溶液凹液面的最低点所对应的刻度作为终读数;
(3)根据关系式HCl~NaOH来解答;
(4)由表中数据判断即可;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)先分析浓度的有效性,然后求出平均值.
解答 解:(1)滴定操作需要的仪器有:滴定管、滴定管夹、铁架台、烧杯外、锥形瓶,除锥形瓶外,实验所需仪器还有滴定管、滴定管夹、铁架台;
故答案为:C;
(2)强酸与强碱反应溶液呈中性,可选用甲基橙或酚酞作指示剂,当滴定达到终点后,读取溶液凹液面的最低点所对应的刻度作为终读数;
故答案为:甲基橙或酚酞;凹液面的最低点;
(3)HCl~NaOH
1 1
0.1000mol/L×17.85mL c(NaOH)×16.75mL
则c(NaOH)=0.1066mol/L,
故答案为:0.1066;
(4)对比表中数据,误差较大的是第1次实验,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析判断,盐酸的体积偏小,
A.滴定管未用HCl溶液润洗,盐酸稀释,浓度偏少,消耗盐酸的体积偏大,故A错误;
B.摇晃锥形瓶时,有液体溅出,待测液偏少,消耗盐酸的体积偏小,故B正确;
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失,消耗盐酸的体积偏大,故C错误;
D.放入NaOH溶液前,锥形瓶内有水,待测液物质的量不变,消耗盐酸的体积不变,故D错误;
故答案为:1;B;
(5)对比表中数据,误差较大的是第1次实验,舍去,另外三次的平均值为$\frac{0.1066+0.1064+0.1067}{3}$mol/L=0.1066mol/L,
故答案为:0.1066.
点评 本题主要考查了酸碱中和滴定的操作、仪器、误差分析和数据处理,难度不大,注意实验的基本操作方法和注意事项.


科目:高中化学 来源: 题型:解答题

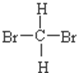 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
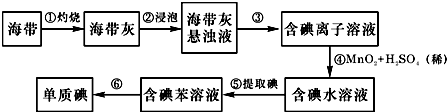
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
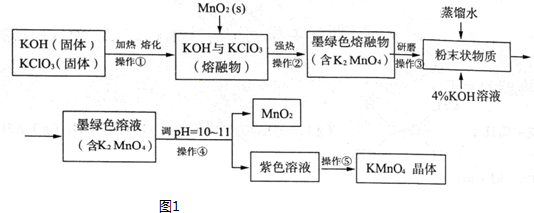
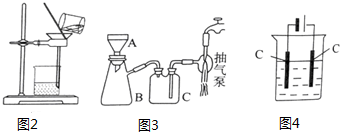
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
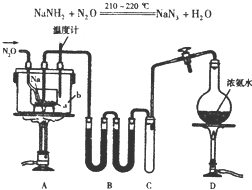 NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:
NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-) | B. | n(NH4+) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | n(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
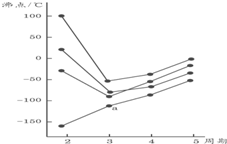
| A. | H2S | B. | CH4 | C. | PH3 | D. | SiH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com