
| A、制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| B、SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| C、用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D、用AgNO3溶液可以鉴别KCl和KI |


科目:高中化学 来源: 题型:
| A、1 mol Cl2与足量的铁反应转移的电子数是2 NA |
| B、常温常压下22.4 L HCl气体含有的分子数是NA |
| C、0.1 mol/L CuCl2溶液中Cl-数目是0.2 NA |
| D、32 g O2中含有的原子数是 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3比NaHCO3的溶度大 |
| B、受热时NaHCO3比Na2CO3稳定 |
| C、澄清的石灰水能与Na2CO3反应而不与NaHCO3反应 |
| D、向相同浓度的NaHCO3与Na2CO3溶液中分别滴入2滴酚酞溶液,前者红色更深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,46 g 红棕色二氧化氮气体中含有N、O原子个数和为3NA |
| B、标准状况下,1 NA CH3Cl所占的体积约为22.4 L |
| C、N2(g)+3H2(g)?2NH3(g)△H=-a kJ/mol,现向一密闭容器中通入2 NA个氨气分子反应完全后,吸收a kJ热量 |
| D、足量铜与1 L 18mol?L-1浓硫酸反应可以得到SO2的分子总数小于9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| Y | Z | ||
| W |
| A、W的原子序数比Z的大9 |
| B、Y的最高价氧化物溶于水,与水反应得到酸 |
| C、W的单质能与Z的一种氧化物的水溶液反应生成两种强酸 |
| D、Z的单质在一定条件下可与铁粉反应,将铁粉氧化为+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
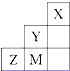
| A、电负性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
D、Z元素基态原子最外层电子排布图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、还原性强弱:F-<Cl-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5g |
| B、5.0 g |
| C、10.0g |
| D、12.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com